Разделы сайта
Выбор редакции:
- Срывать с дерева яблоки и груши
- К чему снится поднимающаяся луна
- К чему приснились рельсы?
- Приметы: к чему чешется или болит грудь?
- Списание компьютерной техники в бухгалтерском учете
- Как заполнить декларацию по налогу на прибыль Заполнение приложение 4 к листу 02 декларации по налогу на прибыль
- Может ли главный бухгалтер выполнять обязанности кассира?
- Можно ли есть трутовик и как защитить от него деревья Трутовик чешуйчатый как солить
- Гусь дикий: описание, фото
- Рецепты приготовления вкусных блюд из куропатки
Реклама
| Определение общей кислотности. Определение щелочности и кислотности воды |
|
Cтраница 1 Общая кислотность так же недостаточно характеризует состав воды, как и общая щелочность (см. разд. И в данном случае, проводя титрование потенциометрически, можно по полученным точкам перегиба на кривой титрования установить содержание в воде различных групп веществ, титруемых едкой щелочью. Общая кислотность: 10 мл пергидроля (30 % НаОг) разбавляют 100 мл воды и к раствору добавляют несколько крупинок платиновой черни или двуокиси марганца для разложения перекиси. Общая кислотность так же недостаточно характеризует состав воды, как и общая щелочность (см. стр. И в данном случае, проводя титрование потенциометрически, можно по полученным точкам перегиба на кривой тритрования установить содержание в воде различных групп веществ, титруемых едкой щелочью. Для дальнейших разделений здесь, так же как и при определении щелочности (см. разд. Как и при определении щелочности, потенциометрическое титрование до известной степени может быть заменено титрованием с двумя индикаторами, цвет которых изменяется при различных значениях рН: один - в кислой среде, другой - в щелочной. Аналогично описанному при определении щелочности здесь могут быть выделены следующие группы веществ, обусловливающих кислотность воды. Общая кислотность так же недостаточно характеризует состав воды, как и общая щелочность (см. стр. И в данном случае, проводя титрование потенциометрически, можно по полученным точкам перегиба на кривой титрования установить содержание в воде различных групп веществ, титруемых едкой щелочью. Общая кислотность так же недостаточно характеризует состав воды, как и общая щелочность (см. стр. Ив данном случае, проводя титрование потенциометрически, можно по полученным точкам перегиба на кривой тритрования установить содержание в воде различных групп веществ, титруемых едкой щелочью. Для дальнейших разделений здесь, так же как и при определении щелочности (см. разд. Как и, при определении щелочности, потенциометрическое титрование до известной степени может быть заменено титрованием с двумя индикаторами, цвет которых изменяется при различных значениях рН: один - в кислой среде, другой - в щелочной. Аналогично описанному при определении щелочности здесь могут быть выделены следующие группы веществ, обусловливающих кислотность воды. Общая кислотность - количество основания, выраженное в мг КОН, которое требуется для нейтрализации всех кислых компонентов, находящихся в 1 г образца. Общая кислотность называется аналитической, или титруемой кислотностью. Общая кислотность Н - катионированной воды при этом равна сумме содержащихся в воде анионов минеральных кислот SO4 -, Cl -, NO - и др. и для вод, не содержащих Na, может быть принята равной некарбонатной жесткости воды. Ввиду того что катионированная вода является кислой, непригодной для питания котлов, процесс Н - катионирования всегда сочетают с Na-катионирова-нием или анионированием, что дает возможность нейтрализовать кислотность и снизить щелочность обработанной воды. Общая кислотность таких растворов составляет 60 - 70 точек, а свободная - 3 - 3 5 точки. Выдержка деталей в концентрированных растворах не уменьшается, но если фтористый натрий заменить нитритом натрия в количестве 2 - 3 г / л, то выдержка может быть сокращена до 15 - 20 мин. Общая кислотность не менее 60 точек, свободная кислотность 1 - 3 точки. Общая кислотность таких растворов составляет 60 - 70 точек, а свободная - 3 - 3 5 точки. Выдержка при этом не уменьшается, но при замене фтористого натрия нитритом натрия в количестве 2 - 3 г / л может быть сокращена до 15 - 20 мин. Фосфатная пленка имеет темно-серый цвет, мелкокристаллическую структуру и обладает хорошей сплошностью. Указанные растворы в смеси с тальком в соотношении 3: 2 применяют для фосфатирования больших поверхностей. Общая кислотность определяется титрованием пробы с фенолфталеином. При нормальном составе на титрование 10 мл пробы идет 28 - 32 мл децинормального раствора едкой щелочи. На практике количество миллилитров раствора щелочи, идущих на титрование, условно выражают в точках. Следовательно, общая кислотность фосфатирующего раствора должна соответствовать 28 - 32 точкам. Свободная кислотность определяется в присутствии индикатора - метилоранжа. Объемный (количественный) анализ. Объемный метод количественного анализа основан на точном измерении реагирующих веществ, концентрация одного из которых известна. Растворы с точно установленной концентрацией называются титрованными , т.к. они используются для определения концентрации исследуемых растворов, то их называют рабочими или стандартными . Процесс прибавления стандартного титрованного раствора к раствору исследуемого вещества называется титрованием. Титрование ведется до достижения точки эквивалентности , т.е. до того момента, когда количество прибавленного стандартного раствора будет эквивалентно количеству определяемого вещества согласно уравнению реакции. Необходимое условие объемного анализа – точная фиксация точки эквивалентности, поэтому используют реакции, конец которых характеризуется определенным внешним признаком (изменение окраски, выпадение осадка). Часто для фиксации точки эквивалентности употребляют специальные вещества, изменяющие цвет или другие свойства с изменением концентрации исследуемого иона. Такие вещества называются индикаторами . Требования к реакциям, применяемым в объемном анализе: Возможность тем или иным способом фиксировать точку эквивалентности; Количественное течение реакции до равновесия, характеризующегося соответствующей величиной константы равновесия реакции; Можно применять только те реакции, которые протекают с достаточной скоростью; При титровании не должны протекать побочные реакции, делающие точное вычисление результатов анализа невозможным. В зависимости от типа реакции, которая протекает при титровании, выделяют методы объемного анализа: 1 Нейтрализация. В основе метода лежит реакция нейтрализации: Н + + ОН - = Н 2 О Этим методом определяют кислотность, щелочность, карбонатную жесткость воды. 2 Окислительно-восстановительные методы, в основе которых применяют окислительно-восстановительные реакции, в ходе которых исследуемое вещество количественно переводят в окисленную или восстановленную форму. 3 Осаждение. Объемные определения метода основаны на осаждении определенного иона в виде труднорастворимого соединения. 4 Комплексометрия. В методе исследуемый ион связывается водным реактивом в малодиссоциированный комплекс. Метод применяется при определении жесткости воды Mg 2+ , Ca 2+ , иона Fe 3+ . Измерение объемов. Для точного измерения в объемном анализе используют бюретки, пипетки, мерные колбы. 1 Бюретки служат для титрования и представляют собой цилиндрические трубки с суженным концом, отсчет ведется сверху вниз. 2 Пипетки служат для точного отмеривания каких-либо определенных объемов исследуемого раствора. 3 Мерные колбы служат для разбавления исследуемого раствора до определенного объема. Щелочность обусловлена присутствием в воде веществ, содержащих гидроксоанион, а также веществ, реагирующих с сильными кислотами (соляной, серной). К таким соединениям относятся: 1 сильные щелочи (KOH, NaOH) и летучие основания (например, NH 3 ×H 2 O), а также анионы, обуславливающие высокую щелочность в результате гидролиза в водном растворе при рН > 8,4 (СО 3 2– , S 2– , PO 4 3– , SiO 3 2– и др.); 2 слабые основания и анионы летучих и нелетучих слабых кислот (HCO 3 – , H 2 PO 4 – , HPO 4 2– , CH 3 COO – , HS – , анионы гуминовых кислот и др.). Щелочность пробы воды измеряется в моль-экв/л или моль-экв/л и определяется количеством сильной кислоты (обычно используют соляную кислоту с концентрацией 0,05 или 0,1 ммоль-экв/л), израсходованной на нейтрализацию раствора. При нейтрализации до значений рН = 8,0 – 8,2 в качестве индикатора используют фенолфталеин. Определяемая таким образом величина называется свободной щелочностью . При нейтрализации до значений рН = 4,2 – 4,5 в качестве индикатора используют метиловый оранжевый. Определяемая данным образом величина называется общей щелочностью . При рН = 4,5 проба воды имеет нулевую щелочность . Соединения первой группы из приведенных выше определяются по фенолфталеину, второй – по метилоранжу. Щелочность природных вод в силу их контакта с атмосферным воздухом и известняками обусловлена, главным образом, содержанием в них гидрокарбонатов и карбонатов , которые вносят значительный вклад в минерализацию воды. Соединения первой группы могут содержаться также в сточных и загрязненных поверхностных водах. Экспериментальная часть Определение свободной щелочности . В коническую колбу наливают 100 мл исследуемой воды, прибавляют 2 – 3 капли индикатора фенолфталеина и титруют раствором HCl до обесцвечивания раствора. Расчет производят по формуле: где х – свободная щелочность воды, мг-экв/л; V (HCl) – объем HCl, мл; 100 – объем взятой пробы. Определение общей щелочности . В ту же колбу, где проводили титрование, добавляют 2 – 3 капли индикатора метилового оранжевого и продолжают титрование до тех пор, пока окраска индикатора из желтой не перейдет в оранжевую. Эксперимент повторяют три раза, результаты эксперимента записывают в таблицу 1. Из полученных результатов находят среднее арифметическое значение объема рабочего раствора. Таблица 1 – Результаты титрования Перед каждым титрованием заполняют бюретку раствором до нулевого деления шкалы. Расчет производят по формуле: где х – общая щелочность воды, мг-экв/л; V (HCl) – объем HCl, мл; С H (HCl) – молярная концентрация эквивалента раствора HCl, моль/л; V (H 2 О) – взятый объем воды, мл. Аналогично щелочности при анализе сточных и технологических вод определяют кислотность воды. Кислотность воды обусловлена содержанием в воде веществ, реагирующих с гидроксоанионами. К таким соединениям относятся: 1) сильные кислоты: соляная HCl, азотная HNO 3 , серная H 2 SO 4 ; 2) слабые кислоты: уксусная CH 3 COOH; сернистая H 2 SO 3 ; угольная H 2 CO 3 ; сероводородная H 2 S и т.п.; 3) катионы слабых оснований: аммоний NH 4 + ; катионы органических аммонийных соединений. Кислотность пробы воды измеряется в моль-экв/л или моль-экв/л и определяется количеством сильной щелочи (обычно используют растворы КОН или NaOH с концентрацией 0,05 или 0,1 моль/л), израсходованной на нейтрализацию раствора. Различают свободную и общую кислотность. Свободная кислотность определяется при титровании до значений рН = 4,3 – 4,5 в присутствии в качестве индикатора метилового оранжевого. В этом диапазоне оттитровываются HCl, HNO 3 , H 2 SO 4 , H 3 PO 4 . Общая кислотность определяется при титровании до значений рН = 8,2 – 8,4 в присутствии фенолфталеина в качестве индикатора. В этом диапазоне оттитровываются слабые кислоты – органические, угольная, сероводородная, катионы слабых оснований. Естественная кислотность обусловлена содержанием слабых органических кислот природного происхождения (например, гуминовых кислот). Загрязнения, придающие воде повышенную кислотность, возникают при кислотных дождях, при попадании в водоемы не прошедших нейтрализацию сточных вод промышленных предприятий и др. Экспериментальная часть Определение свободной кислотности . В коническую колбу наливают 100 мл исследуемой воды, прибавляют 2 – 3 капли индикатора метилового оранжевого и титруют раствором щелочи до перехода оранжевой окраски раствора в желтую. Эксперимент повторяют три раза, результаты эксперимента записывают в таблицу 2. Из полученных результатов находят среднее арифметическое значение объема рабочего раствора. Таблица 2 – Результаты титрования Расчет проводят по формуле: V (NaOH) – объем раствра щелочи, мл; С H (NaOH) – молярная концентрация эквивалента раствора щелочи, моль/л; 100 – объем взятой пробы. Определение общей кислотности . В коническую колбу наливают 100мл исследуемой воды, прибавляют 2 – 3 капли индикатора фенолфталеина и титруют раствором щелочи появления малиновой окраски индикатора. Эксперимент повторяют три раза, результаты эксперимента записывают в таблицу 3. Из полученных результатов находят среднее арифметическое значение объема рабочего раствора. Таблица 3 – Результаты титрования Расчет проводят по формуле:
где х – свободная кислотность воды, мг-экв/л; V (NaOH) – объем раствора щелочи, мл; С H (NaOHl) – молярная концентрация эквивалента раствора щелочи, моль/л; 100 – объем взятой пробы. Вопросы для самоконтроля 1 На титрование 100 мл исследуемой воды пошло 20 мл 0,1 н раствора соляной кислоты по метиловому оранжевому. Определите щелочность воды. 2 Вода содержит (мг/л): CaSO 4 – 50, Ca(HCO 3) 2 – 100, Mg(HCO 3) 2 – 25. Какова величина щелочности. 3 Какова общая щелочность воды, содержащей СО 3 2- – 50 мг/л, НСО 3 - – 122 мг/л. 4 При определении щелочности воды было израсходовано 0,1 н кислоты на титрование 100 мл пробы с индикатором фенолфталеином 3 мл и дополнительно с индикатором метиловым оранжевым 5 мл. Рассчитайте общую и отдельные виды щелочности воды. 5 Вода имеет жесткость равную 9 мг-экв/л. Постоянная жесткость составляет 60 % от общей жесткости (соли натрия отсутствуют). Какова величина щелочности воды. 6 В 1 л воды содержится 210 мг NaHCO 3 и 5,3 мг Na 2 CO 3 . Определите общую щелочность воды. Общая кислотность определяется как диапазон рабочих значений pH фактора в ванне к pH = 8.3. Полная кислотность может использоваться, чтобы контролировать концентрацию химикатов фосфатизации в ванне. SHAPE \* MERGEFORMAT Общая кислотность определяется по образцу объемом 100 мл с добавлением индикатора P12. Титрируем образец с раствором № 2, пока не появится легкий розовый цвет. Количество миллилитров, потребовавшихся для достижения конечной точки, является значением общей кислотности в пунктах (1 мл = 1 пункт). Потребленная кислота Потребленная кислота – это диапазон рабочих значений pH фактора в кислотной ванне до pH =3,5. SHAPE \* MERGEFORMAT Потребленная кислота определяется по образцу объемом 100 мл с добавлением индикатора «E». Титрируем образец с раствором № 1 до изменения цвета от синего до зеленого. Количество миллилитров, потребовавшихся для достижения конечной точки, является значением потребленной кислоты в пунктах (1 мл = 1 пункт). Пункты потребленной кислоты можно затем соотнести к значениям рН и применить для контроля ванн, в которых осуществляется фосфатизация изделий. По мере повышения пунктов потребленной кислоты повышаются также значения рН (то есть при повышении значений рН, будет увеличиваться объем раствора № 1, требующегося для достижения конечной точки). · · Определение общей (титруемой) кислотности продукции общественного питанияОбщей (титруемой) кислотностью называют количество свободных органических кислот и их кислых солей, содержащихся в исследуемой продукции, определяемое титрованием раствором едкой щелочи.Кислотность не только обусловливает вкусовые свойства продукции, но и является показателем свежести и доброкачественности полуфабрикатов из котлетной массы, муки, творога, сиропов, соков и т. д. Кислотность зависит от качества сырья, рецептуры и технологического процесса, а также от условий и сроков хранения. В зависимости от исследуемого объекта кислотность выражается в различных единицах измерения - градусах или процентах преобладающей кислоты. Так, в полуфабрикатах из муки, из котлетной массы, в булочных и кондитерских изделиях под градусом кислотности понимают количество кубических сантиметров 1 моль/дм3 раствора щелочи, необходимое для нейтрализации кислот, содержащихся в 100 г продукции. В полуфабрикатах и изделиях из творога кислотность выражают в градусах Тернера - количество кубических сантиметров 0,1 моль/дм3 раствора щелочи, необходимой для нейтрализации кислот, содержащихся в 100 г продукции. Для перевода градусов в проценты кислоты используют коэффициенты, приведенные в табл. 3.13. В зависимости от консистенции исследуемой продукции определение кислотности проводят непосредственным титрованием (жидкости) или титрованием вытяжки (в продукции, имеющей нежидкую консистенцию). 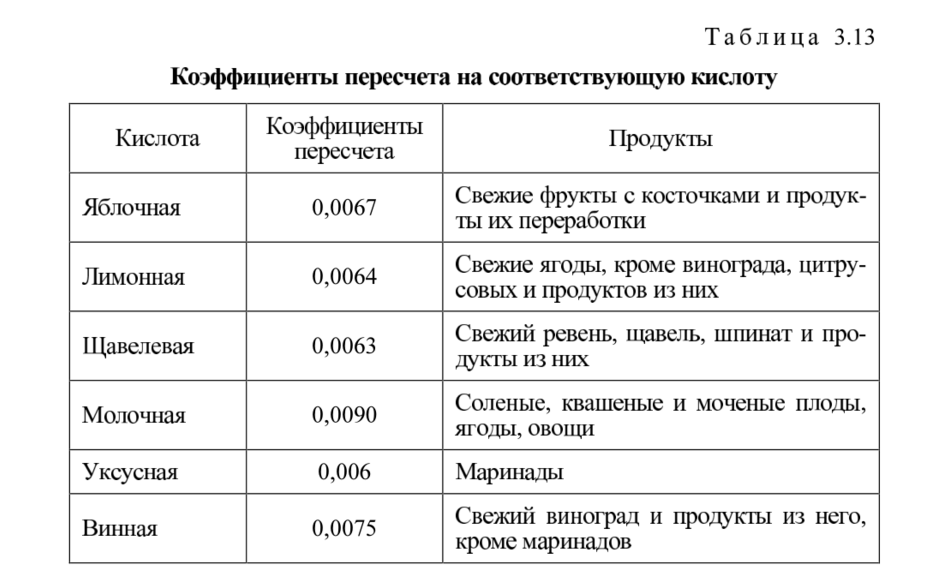 При этом важным является способ приготовления вытяжки, в которую должны переходить все кислые составные части исследуемой пробы при минимальном объеме дистиллированной воды и времени приготовления. Большое значение имеет выбор индикатора. Для бесцветных и сла-боокрашенных растворов применяют фенолфталеин, при титровании окрашенных растворов - тимолфталеин. Определение кислотности титрованием основано на способности щелочи количественно нейтрализовать находящиеся в исследуемом растворе свободные кислоты и их кислые соли. Аппаратура, материалы, реактивы: бюретка со штативом; капельница; химический стакан вместимостью 250 см3; стеклянная палочка; колба мерная вместимостью 250 см3; воронка стеклянная диаметром 5...7 см; конические колбы вместимостью 500 см3 (с пробкой) и 100... 150 см3; ступка фарфоровая; пипетка на 50 см3; 0,1 моль/дм раствор гидроокиси натрия или калия; 1 %-й спиртовой раствор фенолфталеина; 1 %-й спиртовой раствор тимолового синего. Методика определения. В химический стакан объемом 100 см3 помещают навеску подготовленной пробы, взвешивают с точностью до 0,01 г и количественно переносят в мерную колбу объемом 250 см3, используя дистиллированную воду, нагретую до 60...70 °С (количество воды не должно превышать 3Л объема колбы), энергично встряхивают содержимое в течение 2 мин и оставляют на 20...30 мин для настаивания, периодически встряхивая. По истечении настаивания колбу доливают дистиллированной водой до метки, закрывают пробкой и тщательно перемешивают содержимое. Полученную жидкость фильтруют в сухую коническую колбу объемом 200...250 см3 через сухой складчатый фильтр или вату. В две конические колбы объемом 200 см3 пипеткой вносят по 50 см3 фильтрата, добавляют две-три капли 1 %-го спиртового раствора фенолфталеина и титруют 0,1 моль/дм3 раствором NaOH до слабо-розового окрашивания, не исчезающего в течение 1 мин. При использовании спиртового раствора тимолфталеина конец титрования устанавливается по появлению синей окраски, не исчезающей в течение 1 мин. Кислотность в градусах (X, °) вычисляют по формуле  Расхождение между результатами двух параллельных определений не должно превышать 0,2°. За конечный результат принимают среднее арифметическое двух параллельных определений с точностью до 0,1°. Если кислотность необходимо выразить в процентах какой-либо кислоты, то градусы кислотности умножают на соответствующий коэффициент (табл. 3.13). При определении кислотности в градусах Тернера ее рассчитывают по формуле где Х\ - кислотность, °Т; 20 - коэффициент для пересчета результатов титрования в градусы Тернера; К - поправочный коэффициент к 0,1 моль/дм3 раствора щелочи. Расхождение между результатами двух параллельных определений не должно превышать 2 °Т. Определение щелочностиСодержание щелочи регламентируется в мучных кондитерских изделиях, изготовляемых с применением химических разрыхлителей (песочное тесто и выпеченные из него полуфабрикаты, печенье, коржи и др.). Повышенное содержание соды и аммония ухудшает вкус изделий и отрицательно сказывается на пищеварении.Определение щелочности основано на нейтрализации щелочи, содержащейся в навеске исследуемого образца кислотой в присутствии индикатора бромтимолового синего до появления желтого окрашивания. Выражают щелочность в градусах. Под градусом щелочности понимают количество 1 моль/дм раствора соляной кислоты, необходимое для нейтрализации щелочных веществ, содержащихся в 100 г продукта. Аппаратура, матерааты, реактивы: колбы конические вместимостью 500 см; колбы мерные вместимостью 250 см3; пипетка на 50 см3; капельница; 0,1 моль/дм3 раствор соляной кислоты; раствор бромтимолового синего (1 г в 100 см3 этилового спирта). Методика определения. Навеску подготовленной пробы 25 г помещают в химический стакан объемом 100 см3, добавляют небольшое количество дистиллированной воды (30...40 см3), размешивают до однородной консистенции и количественно переносят в мерную колбу объемом 500 см3, тщательно смывая остатки в стакане и на воронке. Общий объем дистиллированной воды 250 см3. Колбу закрывают пробкой, тщательно взбалтывают содержимое и оставляют на 30 мин для настаивания, перемешивая каждые 10 мин. По окончании настаивания содержимое колбы фильтруют через вату в сухую коническую колбу на 250 см3. Для определения щелочности в две конические колбы на 250 см3 вносят пипеткой по 50 см3 фильтрата, добавляют две-три капли бром-тимолового синего и титруют 0,1 моль/дм3 раствором соляной кислоты до появления желтого окрашивания.  Оглавление книги открыть закрыть Качество продукции как социально-экономическая категория. Основные понятия, термины и определения в области качества Общая кислотность так же недостаточно характеризует состав воды, как и общая щелочность (см. разд. И в данном случае, проводя титрование потенциометрически, можно по полученным точкам перегиба на кривой титрования установить содержание в воде различных групп веществ, титруемых едкой щелочью. Общая кислотность Н - катионированной воды при этом равна сумме содержащихся в воде анионов минеральных кислот SC42 -, Cl -, NO3 - и др. и для вод, не содержащих катионы Na, может быть принята равной некарбонатной жесткости воды. Ввиду того, что катиони-рованная вода является кислой, непригодной для питания парогенераторов Н - ка-тионирование всегда сочетают с Na-катионированием или анионированием, что дает возможность нейтрализовать кислотность и снизить щелочность обработанной воды. Общая кислотность раствора определяется титрованием пробы с фенолфталеином. При указанном составе на титрование 10 мл раствора идет 28 - 30 мл децинормального раствора NaOH. Свободная кислотность определяется в присутствии индикатора метилоранжа. На титрование 10 мл пробы должно прйти 3 - 4 мл децинормального раствора NaOH. Количество миллилитров раствора щелочи, пошедшей на титрование, условно выражают в точках. Следовательно, общая кислотность фосфатирующего раствора должна соответствовать 28 - 30 точкам, а свободная кислотность 3 - 4 точкам. Общую кислотность определяют путем титрования пробы испытуемой кислоты раствором едкого натра в присутствии метилового красного. |
Популярное:
Новое
- К чему снится поднимающаяся луна
- К чему приснились рельсы?
- Приметы: к чему чешется или болит грудь?
- Списание компьютерной техники в бухгалтерском учете
- Как заполнить декларацию по налогу на прибыль Заполнение приложение 4 к листу 02 декларации по налогу на прибыль
- Может ли главный бухгалтер выполнять обязанности кассира?
- Можно ли есть трутовик и как защитить от него деревья Трутовик чешуйчатый как солить
- Гусь дикий: описание, фото
- Рецепты приготовления вкусных блюд из куропатки
- Облепиха: полезные свойства ягод, облепихового масла, веток и листьев






