Разделы сайта
Выбор редакции:
- Клаус Джоул Пьяный лепрекон
- Критерии выбора системы электронного документооборота
- Константин Анохин: Мозг и разум Учёные и художники: глаза в глаза
- Проект по внеклассному литературному чтению "весна глазами поэтов, писателей, художников"
- Что относится к трансжирам
- Бурсит тазобедренного сустава лечение препараты Что такое бурсит тазобедренного сустава
- Сонник: к чему снится Покойник
- Журнал кассира операциониста и его заполнение Журнал кассира операциониста титульный лист
- Рецепт: Татарские салаты
- Морской окунь, запеченный в фольге
Реклама
| Гигиена воды. Минеральный состав воды. Уникальное строение воды, её свойства и роль в живой природе |
|
Если капельку природной воды нанести на стекло и подождать, пока она испарится, то на месте капли будут видны белые разводы - это кристаллизуются растворимые в воде соли. Содержание солей в природных водах различается в тысячи раз. Например, в литре дождевой воды содержатся единицы, максимум десятки миллиграммов солей. А в литре воды из залива Кара-Богаз-Гол (Каспийское море) - 300 г, почти треть от массы раствора. Основные (преобладающие) компонентыВ водных растворах подавляющее большинство солей существует в виде ионов. В природных водах преобладают три аниона (гидрокарбонат HCO 3 - , хлорид Cl - и сульфат SO 4 2- ) и четыре катиона (кальций Ca 2+ , магний Mg 2+ , натрий Na + и калий K + ) - их называют главными ионами. Хлорид-ионы придают воде солёный вкус, сульфат-ионы, ионы кальция и магния - горький, гидрокарбонат-ионы безвкусны. Они составляют в пресных водах свыше 90-95 %, а в высокоминерализованных - свыше 99 % всех растворенных веществ. Обычно нижним пределом концентрации для главных ионов считают 1 мг/л, поэтому в ряде случаев, например для морских и некоторых подземных вод, к главным компонентам можно отнести также Br - , B 3+ , Sr 3+ и др. Отнесение ионов K + к числу главных является спорным. В подземных и поверхностных водах эти ионы, как правило, занимают второстепенное положение. Только в атмосферных осадках ионы K + могут играть главную роль.Однако ионная форма главных компонентов свойственна в полной мере лишь маломинерализованным водам. При увеличении концентрации между ионами усиливается взаимодействие, направленное на ассоциацию, т.е. процесс, обратный диссоциации. При этом образуются ассоциированные ионные пары, например MgHCO 3 + , CaHCO 3 + . Под влиянием климатических и других условий химический состав природных вод изменяется и приобретает характерные черты, иногда специфические для различных видов природных вод (атмосферные осадки, реки, озера, подземные воды). Атмосферные осадки из всех природных вод наименее минерализованы, но по химическому составу растворенных в них веществ они не менее разнообразны, чем другие природные воды. Источником их состава являются аэрозоли атмосферы. Ионный состав их довольно разнообразен. При колебаниях средней многолетней минерализации атмосферных осадков в европейской части России в пределах 10-20 мг/л и экстремальных значениях для всей территории 3-4 и 50-60 мг/л ионный состав характеризуется пестротой, причем среди анионов большей частью преобладает SO 4 2- или HCO 3 - , а среди катионов в зависимости от степени удаленности от побережья Ca 2+ или Na + . Непосредственно у побережья при ветре, дующем с моря, в результате ветрового механического выноса солей концентрация хлора в осадках бывает повышенной. По мере удаления от побережья относительная концентрация Cl - падает, а SO 4 2- , Ca 2+ и Mg 2+ , наоборот, повышается. Причиной повышения содержания SO 4 2- и Ca 2+ является обогащение атмосферы аэрозолями континентального происхождения. По мере продвижения в глубь континента часть морских аэрозолей вымывается. Наибольшие изменения испытывает концентрация SO 4 2- . Если увеличение содержания Ca 2+ и Na + связано, скорее всего, с минеральной пылью почв и пород, на поверхности которых всегда присутствуют эти соли, то увеличение содержания SO 4 2- обусловлено, с одной стороны, окислением SO 2 и H 2 S, с другой - поднятием сернокислых солей с засоленных поверхностей.
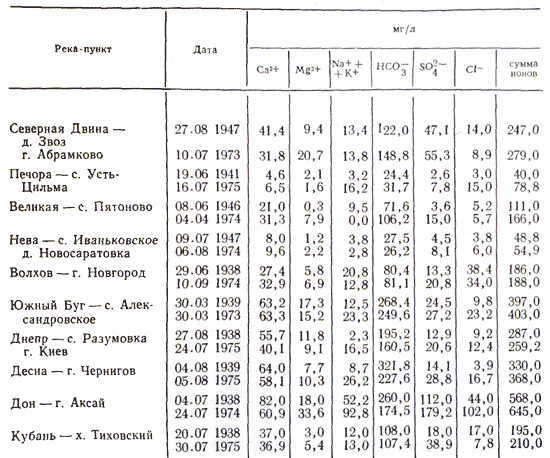
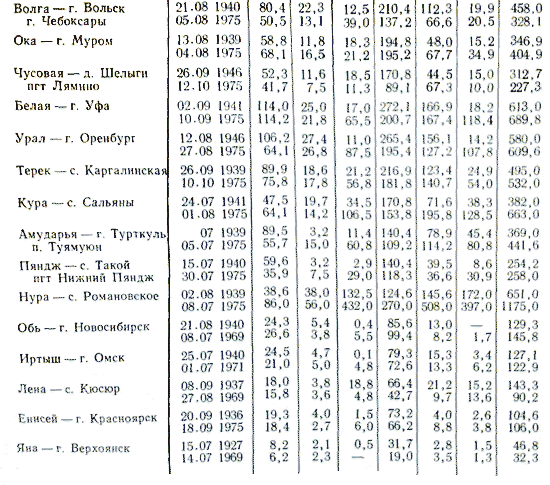
Не поддаются даже приблизительной оценке громадные количества солевых частиц, поднимаемых с почв, соленых озер, поверхности льда, удобрений и, наконец, выбрасываемых химическими и металлургическими производствами, и выбрасываемые в атмосферу в результате другой деятельность людей, а в дальнейшем вымываемые осадками. Воды большинства рек принадлежат к гидрокарбонатному классу. По составу катионов эта вода имеет почти исключительно преобладание кальция; гидрокарбонатные воды с преобладанием магния и натрия - крайне редкое явление. Из природных вод гидрокарбонатного класса наиболее распространены воды малой минерализации (суммарное содержание солей до 200 мг/л). Реки с водой, относящейся к сульфатному классу, сравнительно малочисленны. Они распространены преимущественно в степной полосе и частично в полупустынях. В составе катионов природных вод сульфатного класса, так же как и в водах гидрокарбонатного класса, преобладает кальций. Однако ряд рек сульфатного класса имеет преобладание натрия. По минерализации воды сульфатного класса значительно превосходят воды гидрокарбонатного класса. Речные сульфатные воды с малой (общее количество солей до 200 мг/л) и средней (общее количество солей с 200 до 500 мг/л) минерализацией встречаются сравнительно редко. Наиболее характерна для этих рек повышенная (общее количество солей с 500 до 1000 мг/л), а иногда и высокая (общее количество солей более 1000 мг/л) минерализация воды. Реки, воды которых относятся к хлоридному классу, встречаются почти так же редко, как и реки, в воде которых преобладают сульфаты. К этой территории относятся преимущественно степные районы и полупустыни. Преобладающими катионами природных вод хлоридного класса являются главным образом ионы натрия. Воды хлоридного класса отличаются высокой минерализацией - свыше 1000 мг/л, реже от 500 до 1000 мг/л. Приведенная характеристика ионного состава речной воды относится к периоду летней межени. До некоторой степени она характеризует состав и в период ледостава. Существенно иная, значительно меньшая минерализация воды наблюдается в период весеннего половодья. В распределении ионного состава речной воды на территории России наблюдается определенная закономерность. Имеется общая тенденция к увеличению минерализации воды на большей территории европейской части России с севера на юг и с запада на восток. Зональность ионного состава речных вод объясняется не только действием климатических условий настоящего времени, но и в значительной мере климатом прошлого. Степень выщелоченности почв и пород, наличие в них легкорастворимых солей или засоленность почв - это естественный результат многовекового воздействия соответствующих климатических условий. Нарушают зональность химического состава воды рек на территории России различия состава пород и условий их залегания.
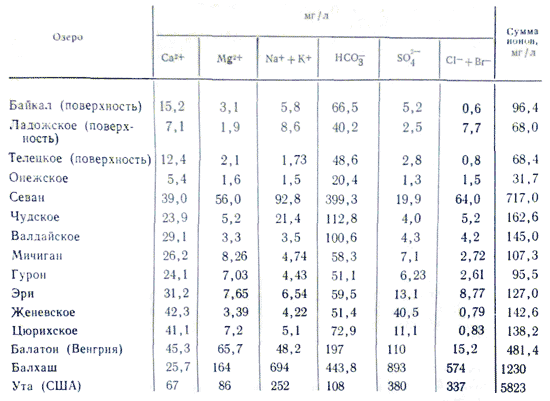
Минерализация и химический состав воды озер в отличие от рек меняется в очень широких пределах. Реки с минерализацией воды свыше 100-200 мг/л, в каких бы условиях они ни находились, - очень редкое явление, в то время как минерализация воды озер бывает от очень низкой, в несколько десятков мг/л (т.е. мало отличающейся от дождевом) до очень высокой 3-3,5% (соляные озера с рассолом до предела насыщенного солями). Различие в минерализации отражается и на ионном составе воды озер. В нем наблюдаются закономерности, которые свойственны и химическому составу речной воды. С увеличением минерализации озерной воды происходит относительный рост ионов в ее составе в такой последовательности: HCO 3 - →SO 4 2- →Cl - ; Ca 2+ →Mg 2+ →Na + . При минерализации до 500-1000 мг/л в составе озерной воды преобладают гидрокарбонатные ионы, свыше 0,1% - чаще всего сульфатные, а по достижении 0,3-0,5% в зависимости от литологических особенностей водосборной площади - сульфатные или хлоридные воды. В составе катионов озерных вод преобладающая роль кальция сохраняется лишь до 0,1-0,2%. При дальнейшем росте минерализации эту роль начинают играть ионы натрия. Ионы магния, так же как и во всех других водах, сохраняют при всех минерализациях промежуточное положение. Причина подобного распределения ионного состава заключается в различной растворимости солей. Подавляющая часть пресных озер, так же как и рек, по составу вод гидрокарбонатно-кальциевые.
Состав морской воды характеризуется большим содержанием солей. Если в водах материкового стока чаще всего наблюдается соотношение концентраций: HCO 3 - > SO 4 2- > Cl - и Ca 2+ > Mg 2+ > Na + или Ca 2+ > Na + > Mg 2+ , то для солоноватых и морских вод, начиная с общей минерализации 1 г/кг, соотношения меняются:: Cl - > SO 4 2- > HCO 3 - и Na + > Mg 2+ > Ca 2+ . Изменение соотношений между нонами от речных к морским водам объясняется последовательным достижением предела растворимости слаборастворимых солей по мере повышения минерализации воды. В сумме ионы и соединения главных компонентов составляют по массе 99,99 % массы всех растворенных в океанской воде минеральных веществ. Между элементами основного солевого состава океанской воды, между каждым из них и их суммой существует практическое постоянство соотношений концентраций. Окончательно его доказал У. Дитмар, выполнивший полный химический анализ (хлориды, сульфаты, кальций, магний, натрий) 77 проб воды, доставленных из всех океанов с различных глубин экспедицией на "Челленджере": в воде открытого океана независимо от абсолютной концентрации количественные соотношения между главными компонентами основного солевого состава всегда постоянны (закон Дитмара). Под влиянием испарения, атмосферных осадков, образования и таяния льдов изменяется лишь общее количество солей, содержащихся в морской воде, но их соотношения в пределах погрешностей определений практически не меняются. Таким образом, если известно точное отношение общего количества солей и концентраций всех основных компонентов в 1 кг воды к концентрации какого-либо одного ингредиента, то лишь по одному определению можно вычислить полный солевой состав океанской воды. В качестве такого "реперного" ингредиента избрана "хлорность", представляющая собой количество граммов ионов хлора, эквивалентное сумме галогенов (кроме фторидов, которые не осаждаются азотнокислым серебром), содержащихся в 1 кг морской воды (определение Серенсена). Постоянство состава океанской воды слегка нарушается под опресняющим влиянием материкового стока в приустьевых участках и во внутренних морях при затрудненном водообмене с океаном. В составе главных компонентов концентрации катионов кальция и магния, а также сумма концентраций анионов слабых кислот (HCO 3 - , CO 3 2- , H 2 BO 3 -) подвержены более чем на 1 % отклонениям от постоянства соотношении в связи с извлечением карбоната кальция из воды в поверхностных слоях и растворением его на глубинах.
Концентрации микроэлементов настолько малы, что в сумме они не превышают 0,01 % массы всех растворенных солей. Из обобщающей сводки В.В. Гордеева и А.П. Лисицына следует, что в наибольших концентрациях встречаются литий (180 мкг/л), рубидий (120 мкг/л), барий (18 мкг/л), в наименьших - золото (0,004 мкг/л), редкоземельные элементы (менее 0,001 мкг/л), радий (10 -7 мкг/л). Чем более изолированно море от океана, тем заметнее отличается состав его воды от состава воды в океане. Первостепенное значение имеют условия водообмена с океаном, соотношение объема материкового стока с объемом моря, глубина моря и характер химического состава вод впадающих рек.
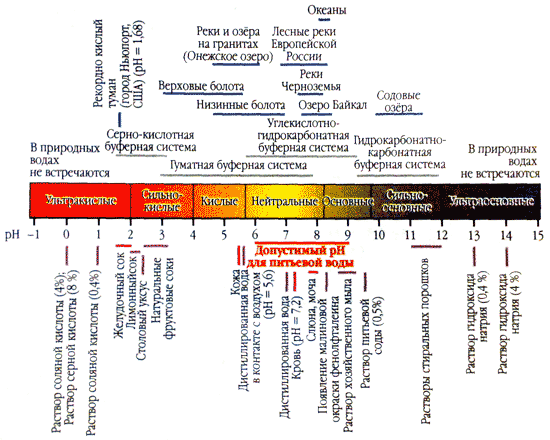
Подземные воды отличаются исключительным разнообразием химического состава, в том числе и ионного. Состав воды бывает всех классов, групп и типов. Ионный состав подземных вод прежде всего зависит от условий их формирования и залегания. Стабилизация pH природной водыПриродная вода способна сохранять значение рН более или менее постоянным, даже если в неё извне попадает определённое количество кислоты или основания. Если в литр дистиллированной воды внести каплю концентрированной соляной кислоты, то рН понизится с 7 до 4. А если каплю соляной кислоты добавить в литр речной воды с рН = 7, показатель почти не изменится. Кислоты и основания, попадающие в природную воду, нейтрализуются растворёнными в ней углекислым газом и гидрокарбонат-ионами:H + + HCO 3 - ↔ H 2 O + CO 2 Гидрокарбонат-ионы нейтрализуют кислоты, попадающие в водоём с атмосферными осадками или образующиеся в результате жизнедеятельности организмов. С концентрацией гидрокарбонат-ионов напрямую связана устойчивость водоёмов к кислотным дождям. Наиболее чувствительны к ним реки и озёра Карелии, Финляндии, Скандинавии, в водах которых этих ионов практически нет.
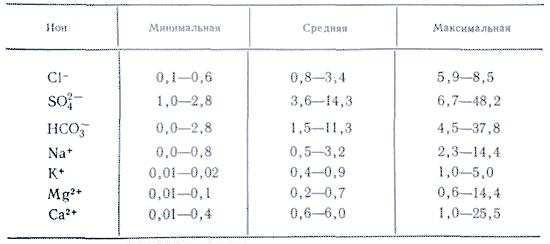
Органические веществаОрганическим веществом природных вод называют комплекс истинно растворенных и коллоидных веществ органических соединений. По происхождению органические вещества природных вод могут быть разделены на поступающие извне (с водосборной площади) и образующиеся в самом водном объекте. К первой группе относятся главным образом гумусовые вещества, вымываемые водой из почв, торфяников, лесного перегноя и других видов природных образований, включающих остатки растений, и органические вещества, поступающие с промышленными и хозяйственно-бытовыми сточными водами. Из гумусовых веществ для гидрохимии наибольший интерес представляют гуминовые и фульвокислоты. Обе эти кислоты характерны для гумуса (гумусовые кислоты), они не содержатся в живых растительных и животных тканях. Соотношение между ними в разных торфах и почвах неодинаково. В черноземных почвах преобладают гуминовые, а в подзолистых - фульвокислогы.Общая концентрация органического вещества в природных водах, изменяясь в широких пределах, бывает наибольшей в болотных водах (в которых при большой концентрации гумусовых веществ она иногда достигает 500 мг/л и более) и реках с болотным питанием, причем болотная вода бывает окрашенной в желтый и коричневый цвет до 300° и выше по платиново-кобальтовой шкале цветности (окраску природной воде придают гуминовые кислоты). Высокая концентрация органического вещества иногда встречается в подземных водах, связанных с нефтеносными месторождениями. Еще большая концентрация может быть в природных водах, загрязненных промышленными и хозяйственно-бытовыми сточными водами. Незагрязненные природные воды обычно содержат мало органических веществ. Например, по Б.А. Скопинцеву, в воде океанов концентрация органического вещества составляет только 2,0-5,4 мг/л (в среднем 3,0 мг/л, а в воде рек в среднем 20 мг/л). В некоторых поверхностных водах, особенно в реках с болотным питанием, вещества гумусового происхождения являются основной частью химического состава воды. После поступления в хорошо аэрируемые реки, а затем озера и моря органические вещества воды подвергаются изменению, и начатый в почвах процесс окисления завершается для большей их части переходом в простые минеральные соединения. Другая, более устойчивая часть остается и накапливается в водных объектах. В холодных климатических зонах (тундре) очень мало органических остатков, и там водоёмы почти не содержат гуминовых кислот. А в зоне лесов, особенно хвойных, где органических остатков образуется много и они не успевают полностью разложиться, содержание гуминоных кислот составляет несколько десятков миллиграммов на литр. Гуминовые кислоты не только подкисляют воду в водоёме, но ещё и связывают практически все тяжёлые металлы в прочные комплексные соединения. Газы в природной водеЕсли налить в стакан холодную воду из-под крана и поставить в тёплое место, на стенках появятся пузырьки газа. Газы были растворены в холодной воде и выделились при нагревании (поскольку растворимость газов при нагревании уменьшается). Это кислород, азот и углекислый газ. Растворимость газа в воде обычно падает с повышением температуры, что связано с повышением кинетической энергии молекул газа, способствующей преодолению сил притяжения молекул воды. Все природные воды представляют газовые растворы. Наиболее широко распространены в поверхностных водах кислород O 2 и двуокись углерода CO 2 , а в подземных - сероводород H 2 S и метан CH 4 . Иногда CO 2 в значительных количествах может насыщать также воды глубоких горизонтов. Кроме того, во всех природных водах постоянно присутствует азот N 2 .Кислород (O 2) находится в природной воде в виде растворенных молекул. Кислород, являясь мощным окислителем, играет особую роль в формировании химического состава природных вод. Кислород поступает в воду в результате происходящих в природе процессов фотосинтеза и из атмосферы. Расходуется кислород на окисление органических веществ, а также в процессе дыхания организмов. Концентрация растворенного кислорода в природных водах колеблется в ограниченных пределах (от 0 до 14 мг/л, при интенсивном фотосинтезе, в полдень, возможна и более высокая концентрация). Вследствие зависимости концентрации кислорода в поверхностных водах от целого ряда факторов его концентрация значительно меняется в течение суток, сезона и года. Так как потребление кислорода сравнительно мало зависит от суточных изменений солнечной радиации, а фотосинтез всецело определяется ею, то в течение дня происходит накопление кислорода, а в темное время суток расходование его. Кислород необходим для существования большинства организмов, населяющих водоемы. Как сильный окислитель кислород играет важную санитарно-гигиеническую роль, способствуя быстрой минерализации органических остатков. Диоксид углерода (CO 2) находится в воде главным образом в виде растворенных молекул газа CO 2 . Однако часть их (около 1 %) вступает во взаимодействие с водой, образуя угольную кислоту: CO 2 + H 2 O ↔ H 2 CO 3 Обычно же не разделяют CO 2 и H 2 CO 3 и под диоксидом углерода подразумевают их сумму (CO 2 + H 2 CO 3). В природных водах источником диоксида углерода являются прежде всего процессы окисления органических веществ, происходящие с выделением CO 2 как непосредственно в воде, так и в почвах и илах, с которыми соприкасается вода. К ним относятся дыхание водных организмов и различные виды биохимического распада и окисления органических остатков. В некоторых подземных водах важным источником диоксида углерода являются вулканические газы, выделяющие из недр земли, происхождение которых связано с дегазацией мантии и со сложными процессами метаморфизации осадочных пород, протекающими в глубинах под влиянием высокой температуры. Поэтому часто в подземных водах и источниках глубинного происхождения наблюдается высокое содержание диоксида углерода. Поглощение водой диоксида углерода из атмосферы имеет более важное значение для воды морей и океана и менее значимо для вод суши. Уменьшение содержания диоксида углерода прежде всего происходит при фотосинтезе. При очень интенсивном фотосинтезе, когда отмечается полное потребление газообразного CO 2 , последний может быть выделен из ионов HCO 3 - : HCO 3 - ↔ CO 3 2- + CO 2 Диоксид углерода расходуется также на растворение карбонатов: CaCO 3 + CO 2 + H 2 O ↔ Ca(HCO 3) 2 Также расходуется на химическое выветривание алюмосиликатов. Уменьшение содержания CO 2 в воде, особенно в поверхностных водах суши, происходит также при выделении его в атмосферу. Вообще CO 2 атмосферы имеет большое значение для CO 2 содержащегося в поверхностных водах, регулируя его содержание там. Между CO 2 атмосферы и CO 2 поверхностных вод существует непрерывный обмен, направленный на установление между ними равновесия, согласно закону Генри-Дальтона. Поскольку парциальное давление диоксида углерода в атмосфере очень невелико (33 Па), то, несмотря на большую растворимость его (при давлении 1013 гПа и температуре 12 °С до 2166 мг/л), равновесие между водой и атмосферой достигается при очень малом содержании CO 2 в воде. При парциальном давлении CO 2 в атмосфере 33 Па растворимость его в воде будет 2166 0,00033=0,715 мг/л (при 12 °С). Обычно же поверхностные воды суши, в которых протекают различные процессы разложения органического вещества и которые связаны с почвами, имеют большее содержание CO 2 и поэтому выделяют его в атмосферу. Лишь при очень сильном фотосинтезе, когда CO 2 практически исчезает, может происходить поглощение CO 2 из атмосферы. Содержание диоксида углерода в природных водах чрезвычайно разнообразно - от нескольких десятых долей до 3000-4000 мг/л. Наименьшая концентрация CO 2 наблюдается в поверхностных водах, особенно минерализованных (моря, соленые озера), наибольшая - в подземных и загрязненных сточных водах. В реках и озерах концентрация CO 2 редко превышает 20-30 мг/л. Растворенный молекулярный азот (N 2) - наиболее постоянный газ в природных водах. В высшей степени химически устойчивый и биологически трудно усвояемый, азот, будучи занесен в глубинные слои океана или подземные воды, меняется главным образом лишь под влиянием физических условий (температура и давление). Растворенный в поверхностных водах азот имеет преимущественно воздушное происхождение. Наряду с этим в природе широко распространен азот биогенного происхождения, возникающий в результате денитрификации. Газ метан (CH4) относится к числу наиболее распространенных газов и подземных водах. В газовой фазе подземных вод почти всегда количественно преобладает азот, двуокись углерода или метан. Основным источником образования метана служат дисперсные органические вещества в породах. Метан и тяжелые углеводороды, нередко встречаются в значительных концентрациях в глубинных подземных водах закрытых структур, связанных с нефтеносными месторождениями. В небольшой концентрации метан наблюдается в природных слоях озер, где он выделяется из ила при разложении растительных остатков, а также в океанических донных отложениях в районах высокой биологической продуктивности. Газ сероводород (H 2 S) является одним из продуктов распада белкового вещества, содержащего в своем составе серу, и поэтому скопление его часто наблюдается в придонных слоях водоемов вследствие гниения различных органических остатков. В нижних частях глубоких озер и морей, где отсутствует водообмен, часто образуется сероводородная зона. При парциальном давлении сероводорода в атмосфере, равном нулю, длительное присутствие его в поверхностных водах невозможно. Кроме того, он окисляется кислородом, растворенным в воде. В реках сероводород наблюдается лишь в придонных слоях, главным образом в зимний период, когда затруднена аэрация водной толщи. Присутствие сероводорода в природных незагрязненных поверхностных водах - сравнительно редкое явление. Гораздо чаще сероводород присутствует в подземных водах, изолированных от поверхности и в сильно загрязненных поверхностных водах, в которых он служит показателем сильного загрязнения и анаэробных условии. МезоэлементыКроме главных ионов, содержание которых в воде достаточно велико, ряд элементов: азот, фосфор, кремний, алюминий, железо, фтор - присутствуют в ней в концентрациях от 0,1 до 10 мг/л. Они называются мезоэлементами (от греч. "мезос" - "средний", "промежуточный").Азот в форме нитратов NO 3 - попадает в водоёмы с дождевой водой, а в форме аминокислот, мочевины (NH 2) 2 CO и солей аммония NH 4 + - при разложении органических остатков. Фосфор существует в воде в форме гидрофосфатов HPO 3 2- и дигидрофосфатов H 2 PO 3 - , образующихся в результате разложения органических остатков. Кремний является постоянным компонентом химического состава природных вод. Этому способствует в отличие от других компонентов повсеместная распространенность соединений кремния в горных породах, и только малая растворимость последних объясняет малое содержание кремния в воде. Концентрация кремния в природных водах обычно составляет несколько миллиграммов в 1 л. В подземных водах она повышается и часто достигает десятков миллиграммов в 1 л, а в горячих термальных водах - даже сотен. На растворимость кремния, кроме температуры сильно влияет повышение pH раствора. Сравнительно малое содержание кремния в поверхностных водах, уступающее растворимости диоксида кремния (125 мг/л при 26 °С, 170 мг/л при 38 °С), указывает на наличие в воде процессов уменьшающих ее концентрацию. К ним надо отнести потребление кремния водными организмами, многие из которых, например диатомовые водоросли, строят свой скелет из кремния. Кроме того, кремниевая кислота как более слабая вытесняется из раствора угольной кислотой: Na 4 SiO 4 + 4CO 2 + 4H 2 O = H 4 SiO 4 + 4NaHCO 3 Способствует неустойчивости кремния в растворе и склонность кремниевой кислоты при определенных условиях переходить в гель. В очень мало минерализованных водах кремний составляет существенную, а иногда и преобладающую часть химического состава воды, несмотря на его малое абсолютное содержание. Присутствие кремния в воде является серьезной помехой в технике, так как при продолжительном кипячении воды кремний образует в котлах очень твердую силикатную накипь. Алюминий поступает в водоёмы в результате действия кислот на глины (каолин): Al 2 (OH) 4 + 6H + = 2SiO 2 + 5H 2 O + 2Al 3+ Основной источник железа - железосодержащие глины. Органические остатки (ниже обозначаются как "С"), находящиеся в контакте с ними, восстанавливают железо до двухвалентного, которое медленно вымывается в форме гидрокарбоната или солей гуминовых кислот: 2Fe 2 O 3 + "C" + 4H 2 O + 7CO 2 = 4Fe(HCO 3) 2 Когда вода с растворёнными в ней ионами Fe 2+ вступает в контакт с воздухом, железо быстро окисляется, образуя коричневый осадок гидроксида Fe(OH) 3 . Со временем он превращается в болотную руду - бурый железняк (лимонит) FeO(OH). Карельская болотная руда использовалась в XVIII-XIX столетиях для получения железа. Синеватая плёнка на поверхности воды - это Fe(OH) 3 , образующийся, когда подземные воды, содержавшие ионы Fe 2+ , вступают в контакт с воздухом. Ее часто путают с масляной пленкой, однако различить их очень легко: у пленки гидроксида железа рваные края. Если поверхность воды слегка взволновать, гидроксидная пленка, в отличие от масляной, не будет переливаться. МикроэлементыК этой группе относятся элементы, соединения которых встречаются в природных водах в очень малых концентрациях, поэтому их и называют микроэлементами. Их концентрация измеряется микрограммами в 1 л (мкг/л), а часто имеет и более малые значения. Микроэлементы представляют собой самую большую группу элементов химического состава природных вод, в нее входят все элементы периодической системы, не включенные в предыдущие группы рассмотренных компонентов. Условно их можно разделить на пять подгрупп: 1) типичные катионы (Li + , Rb + , Cs + , Be 2+ , Sr 2+ , Ba 2+ и др.); 2) ионы тяжелых металлов (Cu 2+ , Ag + , Au + , Pb 2+ , Fe 2+ , Ni 2+ , Co 2+ и др); 3) амфотерные комплексообразователи (Cr, Mo, V, Mn); 4) типичные анионы (Br - , I - , F -); 5) радиоактивные элементы. Микроэлементы необходимы для нормальной жизнедеятельности растений, животных и человека. Однако при повышенной концентрации многие микроэлементы вредны и даже ядовиты для живых организмов. Поэтому часто они становятся загрязняющими веществами и концентрация их контролируется. Успешное изучение микроэлементов затруднено не только их малым содержанием в природных водах, но и в сильнейшей мере неясностью формы их присутствия в растворе. Последнее не только осложняет выяснение закономерностей их миграции и режима но и создает трудности при химическом анализе. Например, многие тяжелые металлы мигрируют в больших концентрациях именно во взвешенном, а не в растворенном состоянии. Растворенные органические комплексы образуют большинство металлов, прежде всего двух- и трехвалентные металлы с гуминовыми и фульвокислотами. Концентрация закомплексованных металлов определяется прежде всего концентрацией органических кислот. В виде коллоидных соединений присутствуют многие гидроксиды металлов. Возможно, происходит адсорбция органических веществ на поверхности коллоидов, что придает им большую стабильность в растворе.Факторы влияющие на химический состав водыХимический состав природной воды определяет предшествующая ему история, т.е. путь, совершенный водой в процессе своего круговорота. Количество растворенных веществ в такой воде будет зависеть, с одной стороны, от состава тех веществ, с которыми она соприкасалась, с другой - от условий, в которых происходили эти взаимодействия. Влиять на химический состав воды могут следующие факторы: горные породы, почвы, живые организмы, деятельность человека, климат, рельеф, водный режим, растительность, гидрогеологические и гидродинамические условия и пр. Рассмотрим лишь некоторые факторы, влияющие на состав воды.Почвенный раствор и фильтрующиеся через почву атмосферные осадки способны усиливать растворение пород и минералов. Это одно из важнейших свойств почвы, влияющее на формирование состава природных вод, является результатом увеличения концентрации диоксида углерода в почвенном растворе, выделяющегося при дыхании живых организмов и корневой системы в почвах и биохимическом распаде органических остатков. Вследствие этого концентрация CO 2 в почвенном воздухе возрастает от 0,033 %, свойственных атмосферному воздуху, до 1 % и более в почвенном воздухе (в тяжелых глинистых почвах концентрация CO 2 в почвенном воздухе достигает иногда 5-10 %, придавая тем самым раствору сильное агрессивное действие по отношению к породам). Другим фактором, усиливающим агрессивное действие фильтрующейся через почву воды, является органическое вещество - почвенный гумус, образующийся в почвах при трансформации растительных остатков. В составе гумуса в качестве активных реагентов прежде всего следует назвать гуминовые и фульвокислоты и более простые соединения, например органические кислоты (лимонная, щавелевая, уксусная, яблочная и др.), амины и т.п. Почвенный раствор, обогащаясь органическими кислотами и CO 2 , во много раз ускоряет химическое выветривание алюмосиликатов, содержащихся в почвах. Аналогично вода, фильтрующаяся через почву, ускоряет химическое выветривание алюмосиликатов и карбонатных пород, подстилающих почву. Известняк легко образует растворимый (до 1,6 г/л) гидрокарбонат кальция: CaCO 3 + H 2 O + CO 2 ↔ Ca(HCO 3) 2 Почти на всей европейской части России (кроме Карелии и Мурманской области) известняки, а также доломиты MgCO 3 CaCO 3 залегают довольно близко к поверхности. Поэтому вода здесь содержит преимущественно гидрокарбонаты кальция и магния. В таких реках, как Волга, Дон, Северная Двина, и основных их притоках гидрокарбонаты кальция и магния составляют от 3/4 до 9/10 всех растворённых солей. Соли попадают в водоёмы и в результате деятельности человека. Так, хлоридами натрия и кальция зимой посыпают дороги, чтобы растапливать лёд. Весной вместе с талой водой хлориды стекают в реки. Треть хлоридов в реках европейской части России привнесена туда человеком. В реках, на которых стоят крупные города, эта доля гораздо больше. Рельеф местности косвенно влияет на состав воды, способствуя вымыванию солей из толщи пород. Глубина эрозионного вреза реки облегчает поступление в реку более минерализованных грунтовых вод нижних горизонтов. Этому же способствуют и другие виды депрессий (речные долины, балки, овраги), улучшающие дренирование водосбора. Климат же, создает общий фон, на котором происходит большинство процессов, влияющих на формирование химическою состава природных вод. Климат прежде всего определяет баланс тепла и влаги, от которого зависит увлажненность местности и объем водного стока, а следовательно, и разбавление или концентрирование природных растворов и возможность растворения веществ или выпадения их в осадок. Огромное влияние на химический состав воды и его изменение с течением времени оказывают источники питания водного объекта и их соотношение. В период таяния снега вода в реках, озерах и водохранилищах имеет более низкую минерализацию, чем в период, когда большая часть питания осуществляется за счет грунтовых и подземных вод. Это обстоятельство используют при регулировании наполнения водохранилищ и сброса из них воды. Как правило, водохранилища наполняют в период весеннего половодья, когда приточная вода имеет меньшую минерализацию. Молекулярная структура Вода - (оксид водорода) Н 2 0 , молекулярная масса 18,016, простейшее устойчивое соединение водорода с кислородом. Жидкость без запаха, вкуса и цвета. Вода - одно из самых распространенных на Земле соединений. Молекулы воды обнаружены в межзвездном пространстве. Вода входит в состав комет, большинства планет солнечной системы и их спутников. Количество воды на поверхности Земли оценивается в 1,39 Ю 18 т, большая часть ее содержится в морях и океанах. Количество доступных для использования пресных вод в реках, озерах, болотах и водохранилищах составляет около 11 10 т. Масса ледников Антарктики, Антарктиды и высокогорных районов 2,4 10 16 т, примерно столько же имеется подземных вод, причем, только небольшая их часть - пресные. В глубинных слоях Земли содержится значительно больше (по- видимому, не менее, чем на порядок) воды, чем на поверхности. В атмосфере находится около 1,3 10 т воды. Вода входит в состав многих минералов и горных пород (глины, гипс и др.), присутствует в почве, является обязательным компонентом всех живых организмов. Изотопный состав. Существует 9 устойчивых разновидностей воды. Содержание их в пресной воде в среднем следующее (%): 1 Н 2 16 О - 99,73; 1 Н 2 18 0 - 2; 1 Н 2 17 О - 0,04; 1 Н 2 Н 16 О - 0,03; остальные пять изотопных разновидностей присутствуют в воде в ничтожных количествах. Кроме стабильных изотопных разновидностей, в воде содержится небольшое количество радиоактивного 3 Н 2 (или Т 2 О). Изотопный состав природных вод разного происхождения варьируется. Особенно непостоянно отношение Н/ Н в пресных водах - в среднем 6900, в морской воде - 5500, во льдах - 5500-9000. Строение молекулы и физические свойства. Атом водорода и кислорода в молекуле воды расположены в углах равнобедренного треугольника с длиной связи 0,0957 нм; валентный угол Н-О-Н 104,5°(рис.1; дипольный момент 6,17 10 -30 Кл м; поляризуемость молекулы 1,45 10 " нм; средний квадрупольный момент - 1,87 10 Кл-м, энергия ионизации 12,6 эВ, сродство к протону 7,1 эВ. При взаимодействии молекулы воды с другими атомами, моле Химический состав воды. В водных растворах подавляющее большинство солей существует в виде ионов. В природных водах преобладают три аниона (гидрокарбонат HCO 3 ", хлорид C 1" и сульфат SO 4) и четыре катиона (кальций Ca 2+ , магний Mg 2+ , натрий Na + и калий K +) - их называют главными ионами. Хлорид-ионы придают воде соленый вкус, сульфат-ионы, ионы кальция и магния - горький, гидрокарбонат-ионы безвкусны. Они составляют в пресных водах свыше 90-95%, а в высокоминерализованных - свыше99 % всех растворенных веществ. Обычно нижним пределом концентрации для главных ионов считают 1 мг/л, поэтому в ряде случаев, например для морских и некоторых подземных вод, к главным компонентам можно отнести также Br - , B 3+ , Sr 3+ и др. Отнесение ионов K + к числу главных является спорным. В подземных и поверхностных водах эти ионы, как правило, занимают второстепенное положение. Только в атмосферных осадках ионы K + могут играть главную роль. Однако ионная форма главных компонентов свойственна в полной мере лишь маломинерализованным водам. При увеличении концентрации между ионами усиливается взаимодействие, направленное на ассоциацию, т. е. процесс, обратный диссоциации. При этом образуются ассоциированные ионные пары, например MgHCO 3 +, CaHCO 3 +.Под влиянием климатических и других условий химический состав природных вод изменяется и приобретает характерные черты, иногда специфические для различных видов природных вод (атмосферные осадки, реки, озера, подземные воды). Соотношение указанных элементов определяет основные свойства вод - щелочность, соленость и жесткость (рис. 2). По анионам выделяют три типа воды: 1) гидрокарбонатные; 2) сульфатные; 3) хлоридные и ряд промежуточных - гидрокарбонатно-сульфатные, сульфатно-хлоридные, хлоридно-сульфатные, а также более сложного состава. Под классификацией природных вод по химическому составу понимают распределение химического состава природных вод на классы по определенным признакам, которое составляет систему. Основой для систематизации в существующих классификациях служат следующие признаки: минерализация воды, концентрация преобладающего компонента или их групп, соотношение между концентрациями разных ионов, наличие повышенных концентраций каких-либо специфических компонентов газового (СО 2 , H 2 S , СН 4 и др.) или минерального (F , Яа и др.) состава. В настоящее время универсальной классификации не существует. К наиболее известным и часто употребляемым относятся классификации природных вод Ч. Пальмера, С. А. Щукарева, О. А. Алекина. Химический состав воды изображают в виде индекса, формулы, графика или диаграммы. По преобладающему аниону воды делятся на три класса: гидрокарбонатные, сульфатные и хлоридные. Воды каждого класса делятся, в свою очередь, по преобладающему катиону на три группы: кальциевую, магниевую и натриевую. Каждая группа подразделяется на 4 типа по соотношению содержащихся в воде ионов (в эквивалентах). При этом класс природных вод обозначается символом соответствующего аниона: С - НСО 3 - , S - SO 4 - , С1 - С1 - ; группа: символом катиона: К+, Na +, Са 2 +, Мg 2 +; тип - римской цифрой. Формула воды записывается следующим образом. К символу класса добавляется нижний индекс - значение минерализации (с точностью до 0,1 г/л), к символу группы - верхний индекс - значение общего катионного состава (с точностью до целых единиц вещества в ммоль/л), например: С 12 № 0,5 - гидро- карбонатно-натриевая вода с общей минерализацией 1,2 г/л и преобладающей концентрацией гидрокарбонатных ионов и ионов натрия. Или Сса11 5 0,4 - это значит, что вода гидрокарбонатного класса, группы кальция, типа II, с минерализацией 0,4 г/дм и жесткостью 5 ммоль/дм (мг-экв/л). В природных водах присутствуют также растворенные газы. В основном это газы, которые диффундируют в воды из атмосферы воздуха, такие как кислород, углекислый газ, азот. Но в то же время в подземных водах или водах нецентрализованных источников водоснабжения, в минеральных и термальных водах могут присутствовать сероводород, радиоактивный газ радон, а также инертные и другие газы. В табл. 1. представлены ионы, наиболее часто встречающиеся в природных водах.
Химические свойства воды Химически чистая вода в обычных условиях - жидкость без цвета, вкуса и запаха. При нормальном атмосферном давлении (1013 гПа или 760 мм.рт.ст.) температура замерзания принята равной 0 о С, а кипения 100 о С. Вода является слабым электролитом. При температуре 25оС примерно 1 на 5 10 9 молекул подвергается электролитической диссоциации по схеме Н 2 О^Н++ОН - . Вода хорошо растворяет многие полярные и диссоциирующие на ионы вещества. Концентрация ионов Н+ и связанная с ней концентрация ионов ОН - - являются важными характеристиками водных растворов и отражают водородный показатель (рН), который представляет десятичный логарифм концентрации водных ионов (моль/л), взятый с обратным знаком. Величина рН обусловливает кислотную или щелочную реакцию водной среды. Минерализация воды. Общая минерализация представляет собой суммарный количественный показатель содержания растворенных в воде веществ. Этот параметр также называют содержанием растворимых твердых веществ или общим солесодержанием, так как растворенные в воде вещества находятся именно в виде солей. Минерализация выражается в мг/л или г/л. В подавляющем большинстве случаев солевой состав природных вод определяется 2+ 2+ + + 2 катионами Са, Mg , Ка, К и анионами НС0 3 - , Cl - , S 0 4 - . Эти ионы называются главными ионами воды или макрокомпонентами ; они определяют химический тип воды. Остальные ионы присутствуют в значительно меньших количествах и называются микрокомпонентами; они не определяют химический тип воды. кальция, магния, калия и натрия) и небольшое количество органических веществ, растворимых в воде. В литературных источниках можно встретить несколько классификаций природных вод по степени минерализации. Наиболее распространена следующая: Пресные - до 1г/л; Слабосолоноватые - 1-3 г/л; Солоноватые - 3-10 г/л; Соленые - 10-50 г/; Рассолы - более 50 г/л. Очень часто общую минерализацию воды путают с сухим остатком. Сухой остаток определяется путем выпаривания литра воды и взвешивания того, что осталось. В результате не учитываются более летучие органические соединения, растворенные в воде. Это приводит к тому, что общая минерализация и сухой остаток могут отличаться на небольшую величину - как, правило, не более 10%. В зависимости от минерализации природные воды можно разделить на следующие категории (табл. 2). Соленость воды - содержание в воде хлоридов и сульфатов Na , Mg , Ca .
Природные воды представляют собой собственно воду - химическое соединение кислорода и водорода - и растворенные в ней вещества, обусловливающие ее химический состав и свойства. В воде растворяются твердые, жидкие и газообразные вещества, которые делятся на три группы: хорошо растворимые (в 100 г воды растворяется более 10 г вещества); плохо растворимые, или малорастворимые (в 100 г воды - менее 1 г вещества); практически не растворимые (в 100 г воды растворяется менее 0,01 г вещества). Минерализацией называют сумму содержащихся в воде минеральных веществ. Минерализацию пресных вод принято выражать в миллиграммах на литр (мг/л) или граммах на литр (г/л), соленых вод рассолов - в граммах на литр или процентах (%). В зависимости от практического применения существует несколько видов классификации природных вод по степени минерализации. Агрегатное состояние воды и фазовые переходы Вода на Земле в зависимости от двух физических характеристик - температуры и давления может находиться в трех агрегатных состояниях или фазах - твердом (лед), жидком (собственно вода) и газообразном (водяной пар). Изменение агрегатного состояния воды называют фазовыми переходами (рис. з). Рис. 3. Диаграмма стояния воды или фазовая диаграмма В ней по оси абсцисс откладывается температура, а по оси ординат - давление. Диаграмма представляет собой три кривые: Кривая АВ - кривая испарения - выражает зависимость давления пара жидкой воды от температуры (или, наоборот, представляет зависимость температуры кипения воды от давления). Другими словами, эта линия отвечает двухфазному равновесию (жидкая вода) D (пар), и число степеней свободы, рассчитанное по правилу фаз, составляет С = 3 - 2 = 1. Такое равновесие называют моновариантным. Это означает, что для полного описания системы достаточно определить только одну переменную - либо температуру, либо давление, т. к. для данной температуры существует только одно равновесное давление и для данного давления - только одна равновесная температура. При давлениях и температурах, соответствующих точкам ниже линии АВ, жидкость будет полностью испаряться, и эта область является областью пара. Для описания системы в данной однофазной области необходимы две независимые переменные (С = 3 - 1 = 2): температура и давление. При давлениях и температурах, соответствующих точкам выше линии АВ, пар полностью сконденсирован в жидкость (С = 2). Верхний предел кривой испарения AB находится в точке В, которая называется критической точкой (для воды 374 o С и 218 атм). Выше этой температуры фазы жидкости и пара становятся неразличимыми (исчезает четкая межфазная граница жидкость/пар), поэтому Ф=1. Линия АС - эта кривая возгонки льда (иногда ее называют линией сублимации), отражающая зависимость давления водяного пара надо льдом от температуры. Эта линия соответствует моновариантному равновесию (лед) D (пар) (С=1). Выше линии АС лежит область льда, ниже - область пара. Линия АБ - кривая плавления, выражает зависимость температуры плавления льда от давления и соответствует моновариантному равновесию (лед) D (жидкая вода). Для больши нства, веществ линия АD отклоняется от вертикали вправо, но поведение воды аномально: жидкая вода занимает меньший объем, чем лед. На основании принципа Ле Шателье можно предсказать, что повышение давления будет вызывать сдвиг равновесия в сторону образования жидкости, т. е. точка замерзания будет понижаться. Исследования, проведенные Бриджменом для определения хода кривой плавления льда при высоких давлениях, показали, что существует семь различных кристаллических модификаций льда, каждая из которых, за исключением первой, плотнее воды. Таким образом, верхний предел линии AD - точка D , где в равновесии находятся лед I (обычный лед), лед III и жидкая вода. Эта точка находится при -22 0 С и 2450 атм. Тройная точка воды (точка, отражающая равновесие трех фаз - жидкости, льда и пара) в отсутствие воздуха находится при 0,0100° С и 4,58 мм рт.ст. Число степеней свободы С=3-3=0 и такое равновесие называют нонвариантным. В присутствии воздуха три фазы находятся в равновесии при 1 атм и при 0 o С. Понижение тройной точки на воздухе вызвано следующим причинами: 1. растворимостью воздуха в жидкой воде при 1 атм, что приводит к снижению тройной точки на 0,0024 o С; 2. увеличением давления от 4,58 мм рт.ст. до 1 атм, которое снижает тройную точку еще на 0,0075 o С. Удельная теплота фазовых переходов воды очень велика. В тройной точке вода одновременно находится во всех трех агрегатных состояниях. Диаграмма состояния воды иллюстрирует две ее аномалии, оказывающие решающее влияние не только на поведение воды на Земле, но и природные условия планеты в целом. По сравнению с веществами, представляющими собой соединения водорода с элементами, находящимися в периодической таблице Менделеева, температура замерзания и кипения воды необычайно высока. Аномально высокие значения температуры замерзания и кипения предопределяют возможность существования воды на планете как в твердом, так и жидком состоянии и служат определяющими условиями основных гидрологических и других природных процессов на Земле. Плотность воды. Плотность - одна из важнейших физических характеристик любого вещества. Она представляет собой массу однородного вещества, приходящуюся на единицу объема и измеряется в кг/м. Плотность воды является функцией температуры, солености, давления, коллоидных взвесей. Вода - единственное вещество, у которого в твердом состоянии плотность меньше, чем в жидком. При нормальном давлении плотность жидкой воды в диапазоне от 0 до 4°С ведет себя аномально, увеличиваясь с возрастанием температуры от 999,87 до 1000 кг/м. Поэтому при охлаждении от 4 до 0°С, т. е. непосредственно перед замерзанием, охлаждающаяся вода не опускается вниз, что сохраняет на глубинах в пресноводных водоемах положительную температуру и предохраняет воду от замерзания, а водные организмы от гибели. При последующем увеличении температуры выше 4 °С плотность воды, как и у всех веществ, уменьшается. Плотность льда заметно меньше жидкой воды, что также аномально. При температуре меньшей 0°С с уменьшением температуры плотность падает и составляет 920 кг/м при температуре - 20°С. Это приводит к тому, что лед, как вещество более легкое, чем вода всплывает и экранизирует водную толщу, защищая ее от охлаждения. Влияние солености на плотность также очень велико. Плотность морской воды может достигать 10251033 кг/м. Морская вода при солености 35%о и нормальном давлении имеет при 0 и 20°С плотность 1028,17 и 1024,78 кг/м соответственно. Температура замерзания воды при увеличении солености на каждые 10% уменьшается приблизительно на 0,54°С, поэтому вода замерзает при отрицательной температуре, составляющей, например, -1,9°С при солености 35%. Физические аномалии воды. Характерные значения температуры воды. Температура наибольшей плотности дистиллированной воды при нормальном давлении 1,01 Ю 5 Па обычно принимается равной 4°С, хотя точное ее значение 3,98°С. Нужно также иметь в виду, что дистиллированной воды в природе нет, а вода так называемых пресных озер и рек всегда немного минерализована. Например, концентрация солей воды оз. Байкал составляет 0,0697кг/м. Поэтому для природных озер и искусственных водохранилищ температура наибольшей плотности воды всегда немного меньше 4°С. Значение коэффициента а для дистиллированной воды, по лабораторным данным, равно 0,0079 °С/Па. Температура кристаллизации (замерзания) дистиллированной воды при нормальном атмосферном давлении принимается равной 0°С и служит начальным значением температурной шкалы термометра Цельсия. Процесс замерзания пресной и соленой воды происходит скачком с выделением теплоты кристаллизации. Обратный процесс, т. е. таяние льда, происходит с поглощением того же количества теплоты, но без скачка, постепенно. Переохлаждение воды в природе, т. е. понижение ее температуры замерзания по отношению к 0°С, наблюдается очень часто. В речных условиях переохлаждение поверхностного слоя воды составляет даже порядка - 1°С. Переохлажденная на поверхности реки вода переносится в глубину турбулентным течением и в благоприятных условиях образует внутриводный (шуга) и донный лед. При этом степень переохлаждения глубинных вод значительно меньше, чем поверхностных. Переохлаждение наблюдается также в озерах и морях, где оно впервые и было обнаружено еще в XVIII в. в виде так называемого якорного льда на опущенных на дно якорях. В лабораторных условиях в капиллярных трубках дистиллированную воду удалось переохладить до температуры - 33°С. К важным особенностям изменения агрегатного состояния воды относятся большая затрата тепла на плавление, испарение, сублимацию и большое выделение тепла при обратных переходах, аномально низкая температура замерзания и высокая температура кипения. Для воды характерны следующие физические аномалии и свойства: Высокая по сравнению с другими веществами температура плавления, поэтому вода на Земле может находиться в твердом состоянии (ледники, снег) и жидком (реки, озера, подземные воды); Плотность льда значительно меньше плотности воды, благодаря этому при замерзании водоема лед экранирует его от дальнейшего охлаждения (лед обладает небольшой теплоемкостью); При увеличении температуры от 0 до 4°С плотность также увеличивается, поэтому при охлаждении поверхностного слоя до 4°С опускание и перемешивание слоев воды прекращается; Удельная теплота ледообразования (количество теплоты затрачиваемое при превращении единицы массы льда при температуре плавления и нормальном атмосферном давлении в воду) очень велика, поэтому процесс ледообразования идет замедленно; Удельная теплота парообразования (количество теплоты, необходимое для превращения единицы массы воды в пар) очень велика, поэтому процесс парообразования и идет замедленно. Тепловые характеристики воды. Удельная теплоемкость (количество теплоты, необходимое для нагревания единицы массы воды на один градус) очень велика, поэтому вода медленно нагревается и медленно охлаждается, тем самым регулирует тепловые процессы на Земле. Теплоемкость - это количество теплоты, поглощаемой телом при нагревании его на 1°С. Определяется она по формуле: C = dQ/dt или C = Q/At, где dQ - бесконечно малое количество теплоты, вызвавшее бесконечно малое повышение температуры dt ; At = t 2 - t 1 - изменение температуры тела, происходящее в результате подвода к нему количества теплоты Q ; t 1 и t 2 - температура тела до и после подвода к нему теплоты. Характеристикой теплоемкости вещества принята удельная теплоемкость - отношение теплоемкости тела к его массе: c = C/m или c = Q/(m At). Удельная теплоемкость воды - это количество теплоты, необходимое для нагревания 1кг дистиллированной воды на 1°С в пределах 14,5 - 15,5 °С. Удельная теплоемкость воды слабо зависит от температуры, поэтому в практических расчетах ее значение может быть принято постоянным, равным 4,2 кДж/(кг°С). Удельная теплоемкость воды уменьшается с повышением температуры. Этим свойством, а также довольно большим значением удельной теплоемкости, вода отличается от всех других веществ, кроме ртути. С увеличением минерализации воды теплоемкость ее уменьшается. Для морской воды при малой солености теплоемкость уменьшается примерно на 0,006кДж/(кг°С) на 1%. Переход воды из жидкого состояния в твердое (кристаллическое - лед) сопровождается выделением теплоты кристаллизации Q KV , а обратный ему процесс - таяние льда - поглощением теплоты плавления Q m .. Эта способность вещества определяется удельной теплотой кристаллизации (плавления): Ькр. = Окр. /тили L ra . = Q i^i M где m - масса затвердевающего (тающего) тела. Удельная теплота кристаллизации воды L K p . - это количество теплоты, которое выделяется при кристаллизации 1 кг воды при постоянной температуре. Для дистиллированной воды она равна 33,3 10 4 Дж/кг. Переход воды из жидкого состояния в газообразное (пар) сопровождается поглощением теплоты испарения Q H . Источником ее обычно служит внутренняя энергия самой жидкости, поэтому при испарении она охлаждается. Обратный испарению процесс - конденсация пара - сопровождается выделением теплоты Q k , равной теплоте испарения. Эта способность вещества определяется удельной теплотой испарения (конденсации): L H = Q H /m или L k = Q K /m . Итак, удельная теплота испарения воды - это количество теплоты, необходимое, чтобы перевести 1 кг воды в парообразное состояние при постоянной температуре. Удельная теплота испарения воды зависит от температуры, при которой испаряется вода. Эта зависимость определяется следующей эмпирической формулой: L H = (25 - 0,024tn ) 10 5 , где 25 10 5 Дж/кг - удельная теплота испарения при температуре поверхности воды, равной 0°С; t n - температура поверхности испаряющейся воды. Температуропроводность - физический параметр вещества и, в частности, воды, способствующий передаче теплоты таким образом, что температура в каждой точке стремится к соответствующему в данный момент установившемуся состоянию. Характеристикой температуропроводности является коэффициент температуропроводности a = X /(cp ), где X - коэффициент теплопроводности. Коэффициент температуропроводности воды слабо зависит от темпера-3 туры: при температуре, равной 0 и 10°С, а соответственно равно 0,485-10" и 0, 504 10 -3 м 2 ч. Отмеченные выше тепловые показатели воды аномальны по сравнению с аналогичными характеристиками других веществ. Это обстоятельство обязано ее структуре, обусловленной водородными связями между молекулами, характеризующимися большей прочностью, чем межмолекулярные взаимодействия. Например, большая теплоемкость воды может быть объяснена только распадом ассоциированных молекул при нагревании. Так как распад этих молекул сопровождается поглощением энергии, то при нагревании воды теплота расходуется не только на повышение температуры, но и на распад ассоциированных молекул. Вязкость, поверхностное натяжение. Вязкость достаточно мала, поэтому вода является очень текучим веществом, она способна переносить различные объекты. Поверхностное натяжение воды достаточно велико, поэтому образуется мениск - капиллярные силы, благодаря которым растения способны брать воду из почвы. Вторым следствием является то, что водяные капли обладают большой ударной силой, и являются одной из причин возникновения эрозии. Вязкость есть физическое свойство вещества (жидкости, газа, твердого тела) оказывать сопротивление перемещению одной его части относительно другой. Вязкость является одним из главных свойств воды. Различают объемную и тангенциальную вязкость. Под объемной вязкостью понимают способность жидкости воспринимать растягивающие усилия. Этот вид вязкости воды проявляется, например, при распространении в ней звуковых и особенно ультразвуковых волн. Тангенциальная вязкость характеризует способность жидкости оказывать сопротивление сдвигающим усилиям. Исследования показывают, что сопротивление жидкости растягивающим и сдвигающим усилиям проявляется лишь при различных скоростях движения одного слоя жидкости по другому, т. е. при возникновении угловых скоростей сдвига частиц. Со стороны слоя, движущегося быстрее, на слой, движущийся медленнее, действует ускоряющая сила. Наоборот, со стороны слоя, движущегося медленнее, на слой, движущийся быстрее, действует тормозящая, задерживающая сила. Эти силы, носящие название сил внутреннего трения, направлены по касательной к поверхности слоев. Поверхностное натяжение воды возникает на поверхности соприкасания ее с воздухом, твердым телом или другой жидкостью. Оно обусловлено силами притяжения между молекулами. Внутри воды силы притяжения между молекулами взаимно компенсируются, а на молекулы, находящиеся вблизи поверхности, действует нескомпенсированная результирующая сила, направленная внутрь от ее поверхности. Поверхностное натяжение стремится уменьшить поверхность жидкости до минимума. Поэтому капли жидкости имеют сферическую форму, а в невесомости - форму шариков (поверхность сферы является наименьшей из всех геометрических фигур равного со сферой объема). Смачивание. При соприкосновении твердого тела с водой смачивание наблюдается в том случае, когда взаимодействие между их молекулами сильнее взаимодействия между молекулами самой воды. В этом случае вода будет стремиться увеличить поверхность соприкосновения и растечется по твердому телу. Когда же взаимодействие между молекулами твердого тела и молекулами соприкасающейся с ним воды более слабое, чем между молекулами самой воды, вода будет стремиться сократить поверхность соприкосновения с твердым телом. По отношению к твердым телам вода обладает свойством полного и частичного смачивания и полного несмачивания. Явление смачивания имеет большое значение при изучении передвижения влаги по капиллярам в почвогрунтах и в снеге. Поверхность смачивающей жидкости, находящейся в узких капиллярах, принимает вогнутую форму. Электрические свойства воды. Удельное электрическое сопротивление воды р э существенно зависит от температуры. Минерализация воды резко понижает ее удельное электрическое сопротивление. Так, у ладожской воды оно составляет 2,610 4 (Ом^м) -1 , а у морской - порядка 4-6 (Ом м) -1 . По приведенным значениям удельного электрического сопротивления можем судить, что чистая вода является плохим проводником электричества. Электрическая проводимость воды может служить показателем загрязнения, как части водоема так и его в целом. Вода является хорошим растворителем. Характеристикой жидкости как растворителя является дипольный момент. У воды он весьма высокий (6,13 10 29 Клм), что обусловливает ее свойства хорошего растворителя веществ, молекулы которых тоже полярны. Однако для сравнения способности одних веществ растворять в себе другие более удобным, чем дипольный момент, оказалось понятие диэлектрической проницаемости. Диэлектрическая проницаемость е показывает, во сколько раз напряженность поля с данным веществом ниже, чем в вакууме. Диэлектрическая проницаемость воды при 20°С е = 81. Способность воды растворять соли возрастает с повышением температуры и понижается с ее уменьшением. Этим обстоятельством объясняется выпадение солей из воды сильно минерализованных озер осенью и в зимний период. Классификация видов движения воды в водных объектах Благодаря малой вязкости вода подвижна и перемещается в сторону уклона поверхности. Водные потоки делятся исходя из типов движения воды на стационарные (если скорость течения не изменяется во времени, dv /dt = 0) и нестационарные (если скорость течения во времени величина переменная, dv /dt Ф 0). Стационарные водные потоки делятся на равномерные (если скорость вдоль потока остается неизменной, dv/dх = 0) и неравномерные (если скорость движения вдоль потока изменяется, dv/dх Ф 0). Существуют два гидродинамических режима движения воды: ламинарный и турбулентный. В ламинарном режиме частицы воды движутся по параллельным траекториям, скорость их движения невелика. Примером ламинарного движения могут служить подземные воды, ледники. В турбулентном режиме движение частиц воды имеет хаотический характер, с относительно большой скоростью. Таким режимом отличаются движения вод в океанах, морях, реках, озерах. Характер движения определяется скоростью движения, гидродинамический режим потока характеризуется числом Рейнольдса (Яе): Яе = vh /v , где h - глубина водоема; v - кинематический коэффициент вязкости, при температуре ~15°С, v = 1* 10" 6 м 2 /с; v - средняя скорость. Если Яе < 300, то поток является ламинарным, если Яе > 3000 - турбулентным, 300< Яе <3000 соответствует переходному гидродинамическому режиму потока. Факторы, определяющие химический состав воды,– химические вещества, которые условно можно разделить на: 1) биоэлементы (йод, фтор, цинк, медь, кобальт); 2) химические элементы, вредные для здоровья (свинец, ртуть, селен, мышьяк, нитраты, уран, СПАВ, ядохимикаты, радиоактивные вещества, канцерогенные вещества); 3) индифферентные или даже полезные химические вещества (кальций, магний, марганец, железо, карбонаты, бикарбонаты, хлориды). Химический состав воды – это возможная причина заболеваний неинфекционной природы. Основы нормирования показателей безвредности химического состава питьевых вод разберем далее. Индифферентные химические вещества в воде Железо двух– или трехвалентное содержится во всех естественных водоисточниках. Железо – необходимая составная часть животных организмов. Оно используется для построения жизненно важных дыхательных и окислительных ферментов (гемоглобина, каталазы). Взрослый человек получает в сутки десятки милиграммов железа, поэтому количество поступающего с водой железа не имеет существенного физиологического значения. Однако присутствие железа в виде больших концентраций нежелательно по эстетическим и бытовым соображениям. Железо придает воде мутность, желто-бурую окраску, горьковато-металлический привкус, оставляет пятна ржавчины. Большое количество железа в воде способствует развитию железобактерий, при отмирании которых внутри труб накапливается плотный осадок. В подземных водах чаще находят двухвалентное железо. Если воду качают, то, соединяясь на поверхности с кислородом воздуха, железо переходит в трехвалентное, и вода приобретает бурый цвет. Таким образом, содержание железа в питьевой воде лимитируется влиянием на мутность и цветность. Допустимой концентрацией по стандарту является не более 0,3 мг/л, для подземных источников не более 1,0 мг/л. Марганец в подземных водах содержится в виде бикарбонатов, хорошо растворимых в воде. В присутствии кислорода воздуха превращается в гидроокись марганца и выпадает в осадок, чем усиливает показатель цветности и мутности воды. В практике централизованного водоснабжения необходимость ограничения содержания марганца в питьевой воде связывается с ухудшением органолептических свойств. Нормируется не более 0,1 мг/л. Алюминий содержится в питьевой воде, подвергшейся обработке – осветлению в процессе коагуляции сернокислым алюминием. Избыточные концентрации алюминия придают воде неприятный, вяжущий привкус. Остаточное содержание алюминия в питьевой воде (не более 0,2 мг на л) не вызывает ухудшения органолептических свойств воды (по мутности и привкусу). Кальций и его соли обуславливают жесткость воды. Жесткость питьевой воды является существенным критерием, по которому население оценивает качество воды. В жесткой воде овощи и мясо плохо развариваются, так как соли кальция и белки пищевых продуктов образуют нерастворимые соединения, которые плохо усваиваются. Затруднена стирка белья, в нагревательных приборах образуется накипь (нерастворимый осадок). Экспериментальные исследования показали, что при питьевой воде с жесткостью 20 мг. экв/л частота и вес образования камней были значительно больше, чем при употреблении воды с жесткостью 10 мг. экв/л. Влияние воды с жесткостью 7 мг. экв на л на развитие уролитиаза не было обнаружено. Все это позволяет считать обоснованным принятый норматив жесткости в питьевой воде – 7 мг экв на л. Биоэлементы Медь в малых концентрациях встречается в природных подземных водах и является истинным биомикроэлементом. Потребность в ней (в основном для кроветворения) взрослого человека невелика – 2-3 г в сутки. Она покрывается в основном суточным пищевым рационом. В больших концентрациях (3-5 мг/л) медь оказывает влияние на вкус (вяжущий). Норматив по этому признаку не более 1 мг/л. в воде. Цинк в качестве микроэлемента встречается в природных поземных водах. В больших концентрациях он встречается в водоемах, загрязненных промышленными сточными водами. Хронические отравления цинком неизвестны. Соли цинка в больших концентрациях действуют раздражительно на ЖКТ, но значение соединений цинка в воде определяется их влиянием на органолептические свойства. При 30 мг/л вода приобретает молочный цвет, а неприятный металлический вкус исчезает при 3 мг/л, поэтому нормируют содержание цинка в воде не более 3 мг/л. Химический состав воды как причина заболеваний неинфекционной природы Развитие медицинской науки позволило расширить представления об особенностях химического (солевого и микроэлементного) состава воды, его биологической роли и возможного вредного влияния на здоровье населения. Минеральные соли (макро– и микроэлементы) принимают участие в минеральном обмене и жизнедеятельности организма, влияют на рост и развитие тела, кроветворение, размножение, входят в состав ферментов, гормонов и витаминов. В организме человека обнаружены йод, фтор, медь, цинк, бром, марганец, алюминий, хром, никель, кобальт, свинец, ртуть и др. В природе постоянно происходит рассеивание микроэлементов (за счет метеофакторов, воды, жизнедеятельности организмов). Это приводит к их неравномерному распределению (недостатку или избытку) в почве и воде различных географических регионов, что ведет к изменению флоры и фауны и появлению биогеохимических провинций. Из заболеваний, связанных с неблагоприятным химическим составом воды, прежде всего выделяют эндемический зоб. Данное заболевание широко распространено и на территории Российской Федерации. Причинами заболевания являются абсолютная недостаточность йода во внешней среде и социально-гигиенические условия жизни населения. Суточная потребность в йоде составляет 120-125 мкг. В местностях, для которых не характерно данное заболевание, поступление йода в организм происходит из растительной пищи (70 мкг йода), из животной пищи (40 мкг), из воздуха (5 мкг) и из воды (5 мкг). Йоду в питьевой воде принадлежит роль индикатора общего уровня содержания этого элемента во внешней среде. Зоб распространен в сельских районах, где население питается исключительно пищевыми продуктами местного происхождения, и в почве йода мало. Жители Москвы и Питера используют воду тоже с низким содержанием йода (2 мкг), но эпидемий здесь нет, так как население питается привозными продуктами из других областей, что обеспечивает благоприятный баланс йода. Основными профилактическими мероприятиями в отношении эндемического зоба являются сбалансированное питание, йодирование соли, добавление меди, марганца, кобальта, йода в рацион. Должна также преобладать углеводистая пища и растительные белки, так как они нормализуют функцию щитовидной железы. Эндемический флюороз – заболевание, появляющееся у коренного населения определенных районов России, Украины и других, ранним симптомом которого является поражение зубов в виде пятнистости эмали. Общепринято, что пятнистость не является следствием местного действия фтора. Фтор, попадая в кровь, оказывает общетаксическое действие, в первую очередь вызывает деструкцию дентина. Питьевая вода – основной источник поступления фтора в организм, чем и определяется решающее значение фтора питьевой воды в развитии эндемического флюороза. Суточный пищевой рацион дает 0,8 мг фтора, а содержание фтора в питьевой воде нередко составляет 2-3 мг/л. Имеется четкая связь между тяжестью поражения эмали и количеством фтора в питьевой воды. Определенное значение для развития флюороза имеют перенесенная инфекция, недостаточное содержание в рационе молока и овощей. Заболевание определяется и социально-культурными условиями жизни населения. Впервые это заболевание было зарегистрировано в Индии, но у англичан и местной аристократии флюороз встречался редко, хотя содержание фтора в воде было на уровне 2-3 мг/л. У индийцев, влачивших полуголодное существование, пятнистость эмали выявлялась уже в тех местностях, где содержание фтора было даже 1,5 мг на 1 л. Профилактическими мероприятиями в отношении действия фтора можно считать: 1) употребление воды с повышенным содержанием минеральных солей; 2) употребление пищи и жидкости с повышенным содержанием кальция (овощи и молочные продукты), так как кальций связывает фтор и переводит его в нерастворимый комплекс Са + F = СаF2; 3) защитную роль витаминов; 4) ультрафиолетовое облучение; 5) дефторирование воды. Флюороз – общее заболевание всего организма, хотя отчетливее всего оно проявляется в поражении зубов. Однако при флюорозе отмечаются: 1) нарушение (торможение) фосфорно-кальциевого обмена; 2) нарушение (торможение) действия внутриклеточных энзимов (фосфотаз); 3) нарушение иммунобиологической активности организма. Выделяют следующие стадии флюороза: 1 – появление меловидных пятен; 2 – появление пигментных пятен; 3 и 4 – появление дефектов и эрозий эмали (деструкция дентина). Содержание фтора в воде нормируется стандартом, так как вредна вода и с малым – 0,5-0,7 мг/л – содержанием фтора, так как развивается кариес зубов. Нормирование проводят по климатическим районам, в зависимости от уровня водопотребления. В 1-2-ом районе – 1,5 мг/л, в 3-м – 1,2 мг/л, в 4-м – 0,7 мг/л. Кариесом поражено 80-90 % всего населения. Это потенциальный источник инфекции и интоксикации. Кариес приводит к нарушению пищеварения и хроническим заболеваниям желудка, сердца и суставов. Убедительным доказательством антикариесного действия фтора является практика фторирования воды. При содержании фтора, равном 1,5 мг/л, заболеваемость кариесом наименьшая. В Норильске после 7 лет фторирования воды у детей 7-летнего возраста заболеваемость кариесом была на 43 % меньше. У лиц, которые употребляют фторированную воду в течение всей жизни, заболеваемость кариесом меньше на 60-70 %. На острове Новая Гвинея люди не знают кариеса, так как содержание фтора в питьевой воде оптимально. Ряд химических веществ вызывают микрохимические загрязнения, или водные интоксикации Так, выделяют группу атерогенных элементов(это медь, кадмий, свинец), избыток которых оказывает неблагоприятное влияние на сердечно-сосудистую систему. Более того, свинец у детей проникает через гематоэнцефалические барьеры, вызывая поражение мозга. Свинец вытесняет кальций из костной ткани. Ртуть вызывает болезнь Минамата (выраженное эмбриотоксическое действие). Кадмий вызывает болезнь Итай-Итай (нарушение обмена липидов). Металлы, опасные по эмбриотоксическому действию образуют, гонадотоксический ряд, который выглядит так: ртуть – кадмий – таллий – серебро – барий -хром – никель – цинк. Мышьяк обладает выраженной способностью к кумуляции в организме, его хроническое действие связано с воздействием на периферическую нервную систему и развитием полиневритов. Бор обладает выраженным гонадотоксическим действием. Нарушает сексуальную активность мужчин и овариально-менструальный цикл у женщин. Бором богаты природные подземные воды Западной Сибири. Ряд синтетических материалов, используемый в водоснабжении, способен вызвать возникновение интоксикации. Это прежде всего синтетические трубы, полиэтилен, фенолформальдегиды, коагулянты и флокулянты (ПАА), смолы и мембраны, используемые в опреснении. Опасны для здоровья попадающие в воду ядохимикаты, канцерогенные вещества, нитрозамины. СПАВ (синтетические поверхностно-активные вещества) стабильны в воде и слаботоксичны, но обладают аллергенным действием, а также способствуют лучшему усвоению канцерогенных веществ и ядохимикатов. При пользовании водой, содержащей повышенные концентрации нитратов, дети раннего грудного возраста заболевают водно-нитратной метгемоглобинемией. Легкая форма заболевания может быть и у взрослых. Это заболевание характеризуется расстройством пищеварения у детей (диспепсии), уменьшением кислотности желудочного сока. В связи с этим в верхних отделах кишечника нитраты восстанавливаются до нитритов NO2. Нитраты поступают в питьевую воду из-за широкой химизации сельского хозяйства, использования азотистых удобрений. У детей рН желудочного сока = 3, что способствует восстановлению нитратов в нитриты и образованию метгемоглобина. К тому же у детей отсутствуют ферменты, восстанавливающие метгемоглобин в гемоглобин. Очень опасно поступление нитратов с детскими смесями, приготовленными на загрязненной воде. Солевой состав – фактор постоянно и длительно воздействующий на здоровье населения. Это фактор малой интенсивности. Отмечено влияние хлоридных, хлоридно-сульфатных и гидрокарбонатных типов вод на: 1) водно-солевой обмен; 2) пуриновый обмен; 3) снижение секреторной и увеличение моторной деятельности органов пищеварения; 4) мочевыделение; 5) кроветворение; 6) сердечно-сосудистые заболевания (гипертоническую болезнь и атеросклероз). Повышенный солевой состав воды сказывается на неудовлетворительных органолептических свойств, что приводит к снижению «водного аппетита» и ограничению ее потребления. Повышенная жесткость (15-20 мг. экв/л) один из факторов развития мочекаменной болезни; и ведёт к развитию эндемического уролитиаза; Затруднено использование воды повышенной жесткости для хозяйственных, бытовых целей, полива; При длительном употреблении высокоминерализованных хлоридных вод отмечается повышенная гидрофобность тканей, способность их удерживать воду, напряжение гипофиз-адреналовой системы; Использование воды хлоридного класса с уровнем общей минерализации более 1 г/л вызывает гипертензивные состояния.! Влияние воды с низкой минерализацией (опресненная, дистиллированная) вызывает: 1) нарушение водно-солевого обмена (снижение обмена хлора в тканях); 2) изменение функционального состояния гипофиз-адреналовой системы, напряжение защитно-приспособительных реакций; 3) отставание прироста и привеса тела. Минимальный допустимый уровень общей минерализации опресненной воды должен быть не менее 100 мг/л. ВОДА (оксид водорода), простейшее устойчивое химическое соединение водорода с кислородом, Н 2 О; при нормальных условиях - жидкость без запаха, вкуса и цвета. Одно из самых распространённых на Земле соединений, играющее исключительно важную роль в разнообразных процессах живой и неживой природы Земли. Истинный состав воды как сложного вещества был впервые установлен А. Лавуазье в 1783 году. Греческое название?δωρ (смотри Гидро...), латинский aqua - аква. Распространённость в природе. Вода образует гидросферу, входит в связанном виде в состав различных минералов и горных пород, является обязательным компонентом всех живых организмов, присутствует в почве и атмосфере. Молекулы воды обнаружены в межзвёздном пространстве; вода входит в состав комет, большинства планет Солнечной системы, спутников. Количество воды на поверхности Земли оценивается в 1,39?10 21 кг, большая часть содержится в морях и океанах (1,34?10 21 кг); смотри также таблицу в статье Воды суши. В глубинных слоях Земли воды значительно больше, чем на поверхности, - (1,1-1,3) ?10 21 кг в литосфере, (1,3-1,5) ?10 22 кг в мантии Земли. Количество доступных пресных вод составляет 2?10 17 кг. В атмосфере находится около 1,3?10 16 кг. На Земле существует постоянный кругооборот воды (смотри Влагооборот, Водный баланс). Природная вода всегда содержит растворённые соли, газы и органические вещества, а также коллоидные частицы и микроорганизмы. Состав примесей зависит от происхождения воды. По минерализации различают следующие виды воды: атмосферные осадки (10-20 мг/кг), ультрапресные (до 200 мг/кг), пресные (200- 500 мг/кг), слабоминерализованные (0,5-1,0 г/кг), солоноватые (1-3 г/кг), солёные (3-10 г/кг), с повышенной солёностью (10-35 г/кг), переходные к рассолам (35-50 г/кг), рассолы (более 50 мг/кг); максимальные концентрации солей содержат вода соляных озёр (до 300 г/кг) и глубокозалегающие подземные воды (до 600 г/кг). В пресных водах преобладают ионы НСО - 3 , Са 2+ , Mg 2+ , Сl - , Na + , SO 2- 4 , К + (смотри также Минеральные воды, Жёсткость воды). К микрокомпонентам природной воды относятся В, Li, Rb, Cu, Zn, Al, Be, W, U, Br, I и др. Из растворённых газов в природных водах присутствуют N 2 , О 2 , СО 2 , благородные газы, редко Н 2 S и углеводороды. Концентрация органических веществ в водах рек около 20 мг/кг, в водах океана - около 4 мг/кг, причём их состав чрезвычайно разнообразен. Смотри также Гидрохимия. Изотопный состав . Существует 9 разновидностей молекул воды, включающих только стабильные изотопы. Их содержание в природной воде в среднем составляет (мол. %): 1 Н 2 16 О - 99,73; 1 Н 2 18 O - 0,2; 1 Н 2 17 O - 0,04; 1 Η 2 Η 16 O - 0,03; остальные присутствуют в ничтожных количествах. Природная вода содержит также радиоактивный тритий. По физическим свойствам изотопные разновидности воды несколько различаются; тяжёлая вода существенно отличается по свойствам от природной. Строение молекулы и физические свойства. Атомы Н и О в молекуле воды расположены в вершинах равнобедренного треугольника с длиной связи О-Н 0,0957 нм; валентный угол Н-О-Н 104,5°. Электронная плотность молекулы воды распределена таким образом, что возникают 4 полюса зарядов, расположенные в вершинах искажённого тетраэдра: два положительных на атомах Н и два отрицательных на неподелённых электронных парах атома О. Дипольный момент 6,17-10 -30 Кл м, энергия ионизации 12,6 эВ, сродство к протону 7,1 эв. Вода может существовать в твёрдом (лёд), жидком и газообразном состояниях. Дипольные молекулы воды взаимодействуют друг с другом и с полярными молекулами других веществ (атомы водорода могут образовывать водородные связи с атомами О, N, F, Cl, S и др.). Каждая молекула воды способна образовывать 4 водородные связи: две - как донор протонов, две - как акцептор. Средняя длина таких связей в кристаллических модификациях льда (известно 10 кристаллических модификаций льда) и кристаллогидратах около 0,28 нм. Угол О—Н???О стремится к 180°. В обычных условиях лёд существует в гексагональной модификации; угол Н-О-Н близок к тетраэдрическому (109,5°), что обусловливает рыхлость структуры льда. При увеличении внешнего давления лёд переходит в модификации с большей плотностью (рис.); максимальная плотность льда 1660 кг/м 3 . Трёхмерная сетка водородных связей, построенная из тетраэдров, сохраняется и в жидкой воде Установлено объединение молекул воды в ассоциаты и даже в обширные кластеры (130 молекул Н 2 О при 0 °С, 90 - при 20 °С, 60 - при 72 °С, время жизни 10 -11 -10 -10 с). Некоторые параметры, характеризующие основные физические свойства воды в различных агрегатных состояниях (при давлении 1013,25 гПа), приведены далее: Строение молекулы воды и наличие водородных связей обусловливают аномалию физических свойств. Так, плотность воды имеет максимум (1000 кг/м 3) при 3,98 °С и при замерзании резко падает (увеличение объёма на 9%). Увеличение плотности при плавлении объясняется вхождением части несвязанных молекул воды в пустоты трёхмерной сетки. С другой стороны, усиливающееся при нагревании тепловое движение молекул обусловливает уменьшение плотности. Наличие этих двух противоположных тенденций объясняет своеобразную - возникновение максимума - зависимость объёма воды от температуры. Наличие пустот в структуре льда является также причиной способности воды к значительному переохлаждению (вплоть до -30 °С). Кроме того, высокая прочность водородных связей (около 21 кДж/моль) объясняет высокие значения температур кипения и плавления, удельных теплот плавления и кипения, диэлектрической проницаемости и др. Аномалии наблюдаются также в температурной зависимости удельной теплоёмкости (минимум при 35 °С), уменьшении вязкости с ростом давления, малой сжимаемости и её уменьшении с ростом температуры. Тройная точка воды (равновесие жидкая вода - лёд - пар) соответствует температуре 0,01 °С и давлению 6,1 гПа. О физических свойствах воды в твёрдом состоянии смотри также в статье Лёд. Вода как растворитель. Высокие диэлектрическая проницаемость и дипольный момент воды определяют её хорошую растворяющую способность по отношению к полярным и ионогенным веществам. Обычно растворимость возрастает с увеличением температуры. Растворимость в воде малополярных веществ (в том числе газов) сравнительно мала. С ростом давления и при понижении температуры растворимость газов возрастает. Многие вещества реагируют с водой при растворении. Между растворёнными в воде ионами, атомами, молекулами, не вступающими с ней в химические реакции, и молекулами воды существуют ион-дипольные и межмолекулярные взаимодействия (смотри Гидратация). Вследствие высокой растворяющей способности воды получить её в чистом виде трудно. Для научных исследований, в медицине и пр. применяют дистиллированную воду, абсолютно чистую воду синтезируют из Н 2 и О 2 . Для бытовых и технических целей воду очищают (смотри Водоподготовка). Химические свойства. Вода - слабый электролит, диссоциирующий по уравнению: Н 2 O → ← Н + +OH - (смотри Электролитическая диссоциация). Протон мгновенно гидратируется с образованием ионов гидроксония Н 3 O + (энтальпия образования -1121,3 кДж/моль). Степень диссоциации воды возрастает при повышении температуры. Диссоциация воды - причина гидролиза солей слабых кислот и оснований. Концентрация ионов Н + - важная характеристика водных растворов (смотри Водородный показатель). Образование воды из элементов при низких температурах происходит крайне медленно; скорость реакции резко возрастает при повышении температуры (при 550 °С - со взрывом). Под действием УФ-излучения происходит фотодиссоциация воды. Ионизирующее излучение вызывает радиолиз воды с образованием Н 2 , Н 2 O 2 и свободных радикалов (Н?, ОН?, HO? 2). Вода окисляется атомарным кислородом до Н 2 О 2 . При взаимодействии воды с F 2 образуются HF и другие соединения. С остальными галогенами при низких температурах вода образует смеси кислот (например, НСl и HClO). При пропускании паров воды через раскалённый уголь Н 2 О разлагается на водяной газ (СО и Н 2). При повышенной температуре в присутствии катализатора реагирует с СО и углеводородами с образованием Н 2 (используют для промышленного получения Н 2 ; смотри Водородная энергетика). Вода взаимодействует с наиболее активными металлами с образованием Н 2 и соответствующего гидроксида. При взаимодействии воды со многими оксидами образуются кислоты или основания. С солями образует кристаллогидраты, со многими газами при низких температурах (инертные газы, углеводороды) - соединения включения, газовые гидраты. Присоединение воды к молекулам непредельных углеводородов лежит в основе промышленного способа получения спиртов, альдегидов и кетонов. Значение . Без воды невозможно существование живых организмов. Воде принадлежит важнейшая роль в геологической истории Земли и возникновении жизни, в формировании среды, климата и погоды. Благодаря высоким значениям удельной теплоёмкости, теплоты плавления и теплоты испарения, вода оказывает стабилизирующее воздействие на температуру поверхности Земли. Аномальная зависимость плотности от температуры и низкая плотность льда препятствуют промерзанию водоёмов, что обусловливает существование в них жизни. Некоторые из физических свойств воды положены в основу определения единиц измерения фундаментальных физических констант (массы, плотности, температуры, теплоты и удельной теплоёмкости). Вода - обязательный компонент многих технологических процессов (в том числе рабочее тело в паровых машинах, растворитель, хладагент, теплоноситель), химический реагент в промышленном производстве ряда кислот, щелочей, кислорода, водорода и пр., компонент лекарственных средств, продуктов питания и пр.; морская и озёрная вода, а также рассолы - сырьевой источник. Смотри также Водные ресурсы. Лит.: Water, а comprehensive treatise / Ed. F. Franks. N.Y., 1972-1982. Vol. 1-7; Pивкин С. Л., Александров А. А. Термодинамические свойства воды и водяного пара: Справочник. 2-е изд. М., 1984; Антонченко В. Я. Физика воды. К., 1986; Зацепина Г. Н. Физические свойства и структура воды. 3-е изд. М., 1998; Яшкичев В. И. Вода, движение молекул, структура, межфазные процессы и отклик на внешние воздействия. М., 1998; Frost Н. Water as а liquid. Mankato, 2000; idem. Water as а solid. Mankato, 2000; idem. Water as а gas. Mankato, 2000; Артемьева С. Вода: (Свойства, ресурсы, использование). Рекомендательный указатель литературы. М., 1981. А. А. Елисеев, Ю. Д. Третьяков. Биологическая роль воды обусловлена её уникальной химической структурой. В водной среде возникла жизнь. Для водных и околоводных организмов вода служит средой обитания. Недостаток воды вызывает нарушение жизнедеятельности всех организмов, а её длительное отсутствие могут переносить лишь покоящиеся формы жизни (споры, семена растений). В большинстве случаев вода является неотъемлемым компонентом живых организмов; она находится внутри клеток и служит основой внеклеточных жидкостей (например, гемолимфа и кровь у животных, флоэмный и ксилемный потоки у растений). Функции воды многообразны - она служит растворителем для различных соединений, средой для реакций обмена веществ, определяет объём клеток и внеклеточных жидкостей, обеспечивает транспорт веществ в организме, участвует в терморегуляции. Содержание воды в разных организмах различается: например, у водорослей на долю воды приходится 90-98%, в листьях наземных растений - 75-86, в семенах злаков - 12-14, у мхов и лишайников - 5-7, у кишечнополостных - 95-98, у насекомых - 45-65, у млекопитающих - 60-70%; неодинаково оно и в различных органах и тканях: например, в корковом веществе почки крыс - 74,6% воды, в мышце - 75,1, в белом веществе мозга - 76,4, в сером - 79,8%. В организм вода поступает из внешней среды; она появляется там также в ходе метаболизма (например, у животных при окислении 100 г жиров образуется 107 мл воды, а при окислении 100 г углеводов - 55 мл). Транспорт молекул воды через биологические мембраны происходит по специальным каналам - аквапоринам. Всасывание воды через мембраны зависит от их осмотической проницаемости и определяется градиентом концентрации осмотически активных веществ по обеим сторонам мембраны. В организме образование воды, практически не содержащей растворённых веществ, происходит в некоторых отделах канальцев выделительных органов, протоках ряда желёз с внешней секрецией и сократительных вакуолях. Образование и выделение гипертонических жидкостей (секреты солевых желёз, моча) способствуют стабилизации водного баланса и осмоляльности (общего количества растворённых веществ) жидкостей внутренней среды организма. У живых существ сформировались системы стабилизации водного обмена при обитании в средах, контрастных по солевому составу и доступности воды (пресные водоёмы, моря, пустыни), это обеспечивается системами осморегуляции и волюморегуляции (поддержания постоянства объёма жидкости тела). В организме человека вода находится в различных жидкостных фазах: внутриклеточной (около 55% всей воды тела) и внеклеточной (45%) - в сосудах (кровь, лимфа) и в межклеточном пространстве. Содержание воды уменьшается с возрастом: у новорождённого ребёнка 79% от массы тела, в возрасте 3-6 месяцев - 70%, у 6-12-месячных - около 60%. У мужчин содержание воды выше, чем у женщин: в возрасте 16-39 лет около 60% от массы тела, в 40-59 лет - 55%, в 60 лет и старше - около 51% и меньше, у женщин соответственно 50, 46,7, 45,5%. Смотри также Водно-солевой обмен и Водный режим растений. Если капельку природной воды нанести на стекло и подождать, пока она испарится, то на месте капли будут видны белые разводы - это кристаллизуются растворимые в воде соли. Содержание солей в природных водах различается в тысячи раз. Например, в литре дождевой воды содержатся единицы, максимум десятки миллиграммов солей. А в литре воды из залива Кара-Богаз-Гол (Каспийское море) - 300 г, почти треть от массы раствора. Основные (преобладающие) компонентыВ водных растворах подавляющее большинство солей существует в виде ионов. В природных водах преобладают три аниона (гидрокарбонат HCO 3 - ,хлорид Cl - исульфат SO 4 2- ) и четыре катиона (кальций Ca 2+ ,магний Mg 2+ ,натрий Na + икалий K + ) - их называют главными ионами. Хлорид-ионы придают воде солёный вкус, сульфат-ионы, ионы кальция и магния - горький, гидрокарбонат-ионы безвкусны. Они составляют в пресных водах свыше 90-95 %, а в высокоминерализованных - свыше 99 % всех растворенных веществ. Обычно нижним пределом концентрации для главных ионов считают 1 мг/л, поэтому в ряде случаев, например для морских и некоторых подземных вод, к главным компонентам можно отнести также Br - , B 3+ , Sr 3+ и др. Отнесение ионов K + к числу главных является спорным. В подземных и поверхностных водах эти ионы, как правило, занимают второстепенное положение. Только в атмосферных осадках ионы K + могут играть главную роль. Однако ионная форма главных компонентов свойственна в полной мере лишь маломинерализованным водам. При увеличении концентрации между ионами усиливается взаимодействие, направленное на ассоциацию, т.е. процесс, обратный диссоциации. При этом образуются ассоциированные ионные пары, например MgHCO 3 + , CaHCO 3 + . Под влиянием климатических и других условий химический состав природных вод изменяется и приобретает характерные черты, иногда специфические для различных видов природных вод (атмосферные осадки, реки, озера, подземные воды). Атмосферные осадки из всех природных вод наименее минерализованы, но по химическому составу растворенных в них веществ они не менее разнообразны, чем другие природные воды. Источником их состава являются аэрозоли атмосферы. Ионный состав их довольно разнообразен. При колебаниях средней многолетней минерализации атмосферных осадков в европейской части России в пределах 10-20 мг/л и экстремальных значениях для всей территории 3-4 и 50-60 мг/л ионный состав характеризуется пестротой, причем среди анионов большей частью преобладает SO 4 2- или HCO 3 - , а среди катионов в зависимости от степени удаленности от побережья Ca 2+ или Na + . Непосредственно у побережья при ветре, дующем с моря, в результате ветрового механического выноса солей концентрация хлора в осадках бывает повышенной. По мере удаления от побережья относительная концентрация Cl - падает, а SO 4 2- , Ca 2+ и Mg 2+ , наоборот, повышается. Причиной повышения содержания SO 4 2- и Ca 2+ является обогащение атмосферы аэрозолями континентального происхождения. По мере продвижения в глубь континента часть морских аэрозолей вымывается. Наибольшие изменения испытывает концентрация SO 4 2- . Если увеличение содержания Ca 2+ и Na + связано, скорее всего, с минеральной пылью почв и пород, на поверхности которых всегда присутствуют эти соли, то увеличение содержания SO 4 2- обусловлено, с одной стороны, окислением SO 2 и H 2 S, с другой - поднятием сернокислых солей с засоленных поверхностей.
Не поддаются даже приблизительной оценке громадные количества солевых частиц, поднимаемых с почв, соленых озер, поверхности льда, удобрений и, наконец, выбрасываемых химическими и металлургическими производствами, и выбрасываемые в атмосферу в результате другой деятельность людей, а в дальнейшем вымываемые осадками. Воды большинства рек принадлежат к гидрокарбонатному классу. По составу катионов эта вода имеет почти исключительно преобладание кальция; гидрокарбонатные воды с преобладанием магния и натрия - крайне редкое явление. Из природных вод гидрокарбонатного класса наиболее распространены воды малой минерализации (суммарное содержание солей до 200 мг/л). Реки с водой, относящейся к сульфатному классу, сравнительно малочисленны. Они распространены преимущественно в степной полосе и частично в полупустынях. В составе катионов природных вод сульфатного класса, так же как и в водах гидрокарбонатного класса, преобладает кальций. Однако ряд рек сульфатного класса имеет преобладание натрия. По минерализации воды сульфатного класса значительно превосходят воды гидрокарбонатного класса. Речные сульфатные воды с малой (общее количество солей до 200 мг/л) и средней (общее количество солей с 200 до 500 мг/л) минерализацией встречаются сравнительно редко. Наиболее характерна для этих рек повышенная (общее количество солей с 500 до 1000 мг/л), а иногда и высокая (общее количество солей более 1000 мг/л) минерализация воды. Реки, воды которых относятся к хлоридному классу, встречаются почти так же редко, как и реки, в воде которых преобладают сульфаты. К этой территории относятся преимущественно степные районы и полупустыни. Преобладающими катионами природных вод хлоридного класса являются главным образом ионы натрия. Воды хлоридного класса отличаются высокой минерализацией - свыше 1000 мг/л, реже от 500 до 1000 мг/л. Приведенная характеристика ионного состава речной воды относится к периоду летней межени. До некоторой степени она характеризует состав и в период ледостава. Существенно иная, значительно меньшая минерализация воды наблюдается в период весеннего половодья. В распределении ионного состава речной воды на территории России наблюдается определенная закономерность. Имеется общая тенденция к увеличению минерализации воды на большей территории европейской части России с севера на юг и с запада на восток. Зональность ионного состава речных вод объясняется не только действием климатических условий настоящего времени, но и в значительной мере климатом прошлого. Степень выщелоченности почв и пород, наличие в них легкорастворимых солей или засоленность почв - это естественный результат многовекового воздействия соответствующих климатических условий. Нарушают зональность химического состава воды рек на территории России различия состава пород и условий их залегания. Минерализация и химический состав воды озер в отличие от рек меняется в очень широких пределах. Реки с минерализацией воды свыше 100-200 мг/л, в каких бы условиях они ни находились, - очень редкое явление, в то время как минерализация воды озер бывает от очень низкой, в несколько десятков мг/л (т.е. мало отличающейся от дождевом) до очень высокой 3-3,5% (соляные озера с рассолом до предела насыщенного солями). Различие в минерализации отражается и на ионном составе воды озер. В нем наблюдаются закономерности, которые свойственны и химическому составу речной воды. С увеличением минерализации озерной воды происходит относительный рост ионов в ее составе в такой последовательности: HCO 3 - →SO 4 2- →Cl - ; Ca 2+ →Mg 2+ →Na + . При минерализации до 500-1000 мг/л в составе озерной воды преобладают гидрокарбонатные ионы, свыше 0,1% - чаще всего сульфатные, а по достижении 0,3-0,5% в зависимости от литологических особенностей водосборной площади - сульфатные или хлоридные воды. В составе катионов озерных вод преобладающая роль кальция сохраняется лишь до 0,1-0,2%. При дальнейшем росте минерализации эту роль начинают играть ионы натрия. Ионы магния, так же как и во всех других водах, сохраняют при всех минерализациях промежуточное положение. Причина подобного распределения ионного состава заключается в различной растворимости солей. Подавляющая часть пресных озер, так же как и рек, по составу вод гидрокарбонатно-кальциевые. Состав морской воды характеризуется большим содержанием солей. Если в водах материкового стока чаще всего наблюдается соотношение концентраций: HCO 3 - > SO 4 2- > Cl - и Ca 2+ > Mg 2+ > Na + или Ca 2+ > Na + > Mg 2+ , то для солоноватых и морских вод, начиная с общей минерализации 1 г/кг, соотношения меняются:: Cl - > SO 4 2- > HCO 3 - и Na + > Mg 2+ > Ca 2+ . Изменение соотношений между нонами от речных к морским водам объясняется последовательным достижением предела растворимости слаборастворимых солей по мере повышения минерализации воды. В сумме ионы и соединения главных компонентов составляют по массе 99,99 % массы всех растворенных в океанской воде минеральных веществ. Между элементами основного солевого состава океанской воды, между каждым из них и их суммой существует практическое постоянство соотношений концентраций. Окончательно его доказал У. Дитмар, выполнивший полный химический анализ (хлориды, сульфаты, кальций, магний, натрий) 77 проб воды, доставленных из всех океанов с различных глубин экспедицией на "Челленджере": в воде открытого океана независимо от абсолютной концентрации количественные соотношения между главными компонентами основного солевого состава всегда постоянны (закон Дитмара). Под влиянием испарения, атмосферных осадков, образования и таяния льдов изменяется лишь общее количество солей, содержащихся в морской воде, но их соотношения в пределах погрешностей определений практически не меняются. Таким образом, если известно точное отношение общего количества солей и концентраций всех основных компонентов в 1 кг воды к концентрации какого-либо одного ингредиента, то лишь по одному определению можно вычислить полный солевой состав океанской воды. В качестве такого "реперного" ингредиента избрана "хлорность", представляющая собой количество граммов ионов хлора, эквивалентное сумме галогенов (кроме фторидов, которые не осаждаются азотнокислым серебром), содержащихся в 1 кг морской воды (определение Серенсена). Постоянство состава океанской воды слегка нарушается под опресняющим влиянием материкового стока в приустьевых участках и во внутренних морях при затрудненном водообмене с океаном. В составе главных компонентов концентрации катионов кальция и магния, а также сумма концентраций анионов слабых кислот (HCO 3 - , CO 3 2- , H 2 BO 3 -) подвержены более чем на 1 % отклонениям от постоянства соотношении в связи с извлечением карбоната кальция из воды в поверхностных слоях и растворением его на глубинах.
Концентрации микроэлементов настолько малы, что в сумме они не превышают 0,01 % массы всех растворенных солей. Из обобщающей сводки В.В. Гордеева и А.П. Лисицына следует, что в наибольших концентрациях встречаются литий (180 мкг/л), рубидий (120 мкг/л), барий (18 мкг/л), в наименьших - золото (0,004 мкг/л), редкоземельные элементы (менее 0,001 мкг/л), радий (10 -7 мкг/л). Чем более изолированно море от океана, тем заметнее отличается состав его воды от состава воды в океане. Первостепенное значение имеют условия водообмена с океаном, соотношение объема материкового стока с объемом моря, глубина моря и характер химического состава вод впадающих рек.
Подземные воды отличаются исключительным разнообразием химического состава, в том числе и ионного. Состав воды бывает всех классов, групп и типов. Ионный состав подземных вод прежде всего зависит от условий их формирования и залегания. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Популярное:
Проект на тему шоколад польза или вред
|
Новое
- Критерии выбора системы электронного документооборота
- Константин Анохин: Мозг и разум Учёные и художники: глаза в глаза
- Проект по внеклассному литературному чтению "весна глазами поэтов, писателей, художников"
- Что относится к трансжирам
- Бурсит тазобедренного сустава лечение препараты Что такое бурсит тазобедренного сустава
- Сонник: к чему снится Покойник
- Журнал кассира операциониста и его заполнение Журнал кассира операциониста титульный лист
- Рецепт: Татарские салаты
- Морской окунь, запеченный в фольге
- Что можно делать с лисичками грибами